Atomy to nieskończenie małe cząstki, które tworzą całą materię we wszechświecie. Z biegiem czasu pomysł na to, jak wyglądałaby struktura atomowa, zmieniał się wraz z nowymi odkryciami naukowców. Więcej na ten temat dowiesz się w tekścieEwolucja modelu atomowego.
Model jest reprezentacją rzeczywistości (nie samej rzeczywistości), więc modele atomowe są reprezentacjami główne składniki atomu i jego budowę oraz wyjaśniają pewne fizyczne i chemiczne zachowania materii. Dzieje się tak, ponieważ człowiek nie jest jeszcze w stanie zobaczyć izolowanego atomu nawet pod ultramikroskopami.
Aby zorientować się, jak mały jest atom, wiedz, że Najmniejsza cząsteczka widoczna pod zwykłym mikroskopem zawiera ponad dziesięć miliardów atomów! Atom jest tak mały, że, gdybyśmy ustawili ich milion obok siebie, nie dotarlibyśmy do grubość włosa.
Mapa myśli: Atom
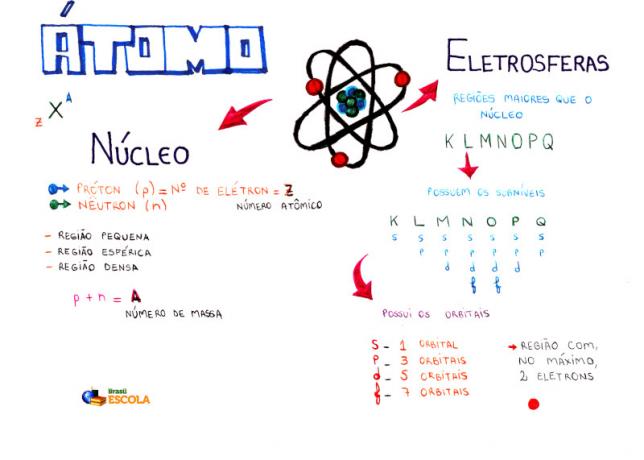
* Aby pobrać mapę myśli w formacie PDF, Kliknij tutaj!
Wśród modeli atomowych najczęściej używanym obecnie w szkole średniej do zrozumienia budowy atomu i jego właściwości jest model Rutherforda-Bohra. Zgodnie z tym modelem struktura atomu składa się z dwóch głównych części:
rdzeń i elektrosfera.
Dwie główne części struktury atomu - elektrosfera i jądro
* Rdzeń: Stanowiąc centralną część atomu, jest zwarty, masywny i bardzo gęsty, a ponadto tworzą go cząstki o większej masie, którymi są protony i neutrony.

Ilustracja protonów i neutronów tworzących jądro atomowe
- Protony: są to cząstki o dodatnim ładunku elektrycznym (ładunek względny = +1; ładunek w kulombie (C) = +1,602. 10-19) a jego masa względna jest równa 1.
Fakt, że protony tworzą jądro i nadają mu ogólny ładunek dodatni, został odkryty przez Eugen Goldstein, w 1886 r. poprzez modyfikację ampułki Crookesa i kilka eksperymentów. Zauważył, że pod bardzo wysokim napięciem pojawiły się emisje (promienie anodowe - pozostałości atomów gazu, które znajdowały się wewnątrz żarówki i których elektrony zostały wyrwane przez wyładowanie elektryczne). Poprzez umieszczenie pola elektrycznego lub magnetycznego na zewnątrz żarówki promienie te zostały odchylone w kierunku bieguna ujemnego. Oznaczało to, że istniały dodatnie cząstki subatomowe, które nazwano protonami.
Później, Ernest Rutherford (1871-1937) wykonał eksperyment opisany w tekście Atom Rutherforda, co doprowadziło go do odkrycia lokalizacji protonu: w jądrze.
- Neutrony: są to cząstki o masie równej masie protonów (1), ale jak sama nazwa wskazuje, są obojętne, to znaczy nie mają ładunku elektrycznego.
Neutrony zostały odkryte w 1932 roku przez James Chadwick (1891-1974), którzy zdali sobie sprawę, że jądro radioaktywnego berylu emituje obojętne cząstki o masie w przybliżeniu równej masie protonów (w rzeczywistości jest nieco większa).
Teraz nie przestawaj... Po reklamie jest więcej ;)
Średnica jądra zależy od ilości protonów i neutronów w atomie, ale średnio wynosi około 10-14 miesiąc i 10-15 m.
Jądro atomowe skupia praktycznie całą masę atomu, będąc bardzo małą częścią: zarówno proton, jak i neutron są około 100 000 razy mniejsze niż sam atom! Dla porównania wyobraźmy sobie, że powiększamy jądro atomu pierwiastka wodór (który ma tylko proton) do rozmiarów piłki tenisowej, najbliższy elektron byłby oddalony o około trzy kilometry dystans! Nawet gdyby atom został powiększony do wysokości 14-piętrowego budynku, jego rdzeń byłby wielkości ziarenka soli na siódmym piętrze. To naprawdę coś niesamowitego, nie sądzisz?!
* Elektrosfera: Jest obszar, w którym elektrony krążą wokół jądra. Pomimo tego, że jest obszarem o znacznie większej objętości niż jądro, jest praktycznie pusty, ponieważ każdy elektron jest 1836 razy mniejszy niż 1 proton (lub 1 neutron). Dlatego masa atomu jest praktycznie cała w jądrze. Elektrony to cząstki o ujemnym ładunku elektrycznym (-1).
Elektrony zostały odkryte w 1897 roku przez Józefa Johna Thomsona (1856-1940), twórca Model atomowy Thomsona. Eksperyment Thomsona można szczegółowo zobaczyć w tekście Eksperyment Thomsona z wyładowaniami elektrycznymi, ale w skrócie, użył wspomnianej ampułki Crookesa i zdał sobie sprawę, że promienie katodowe są zawsze przyciągany przez biegun dodatni, co dowodzi, że atom ma cząstki ujemne, które nazwano elektrony.
Elektrony wirują wokół jądra miliardy razy na milionową część sekundy, kształtując atom i sprawiając, że zachowuje się jak ciało stałe.
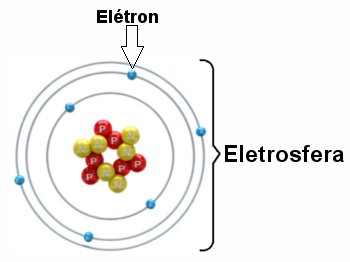
Ilustracja elektrosfery z trzema warstwami elektronowymi i elektronami obracającymi się wokół jądra.
Krótko mówiąc, możemy stworzyć tabelę, aby rozróżnić trzy główne cząstki subatomowe, które są częścią struktury atomu:

Masa i ładunek elektryczny trzech głównych cząstek subatomowych - protonów, neutronów i elektronów
Atomy wszystkich pierwiastków chemicznych składają się z tych trzech cząstek subatomowych. To, co różni jeden pierwiastek chemiczny od drugiego, to ilość, w jakiej pojawiają się te cząstki, a zwłaszcza ilość protonów w jądrze, którą nazywamy liczbą atomową. Ucz się o tym w tekście. Pierwiastek chemiczny.
* Mapa myśli autorstwa Diogo Lopes
Jennifer Fogaça
Absolwent chemii
Chemia
Klasyfikacja materii, wody, cyjanowodoru, dwutlenku węgla, amoniaku, wodoru, helu, substancji substancje proste, złożone, mieszaniny, fazy mieszaniny, mieszanina jednorodna, mieszanina heterogeniczny.



