Tak dobrze jak cyklany, alkeny, alkiny, m.in alkadieny również cierpią wezwania reakcje dodawania. W tekście o reakcje w dienach, przekonasz się, że reakcje addycji zależą od rodzaju dienu, nad którym pracujesz. Dieny można ogólnie podzielić na:
skondensowane lub zakumulowane (brak pojedynczego wiązania między dwoma podwójnymi);
Np.: H2C = CH-CH3
sprzężony lub naprzemienny (tylko pojedyncze wiązanie między dwoma podwójnymi);
Np.: H2C = CH—CH = CH2
odosobniony (co najmniej dwa pojedyncze wiązania między dwoma podwójnymi).
Np.: H2C = CH-CH2— CH2—CH = CH2
Reakcja Dielsa-Aldera został opracowany w 1928 roku przez dwóch niemieckich chemików, Otto Paula Hermanna Dielsa i Kurta Aldera. Jest to bardzo ważna reakcja w chemii organicznej, ponieważ umożliwia:
zidentyfikować węglowodory dienowe;
uzyskać nasycone węglowodory cykliczne (korzystnie cykloheksany).
Ta reakcja organiczna zachodzi tylko w alkadieny lub dieny sprzężone lub naprzemienne i nazywa się dodatek 1.4. Związek, w którym w prostszy sposób możemy zaobserwować addycję 1,4, to but-1,3-dien, przedstawiony poniżej:
H2C = CH—CH = CH2
UWAGA: W tym związku mamy występowanie zjawisko rezonansu, w którym elektrony z dwóch wiązań pi przechodzą przez łańcuch. Para elektrony pi zaczyna zajmować centralny region łańcucha (między węglami 2 i 3), podczas gdy elektrony z drugiego wiązania pi są przesunięte do jednego z końcowych węgli. Tak więc mamy miejsca wiązania na węglach 1 i 4 oraz podwójne między węglami 2 i 3.

Rezonans w strukturze but-2,3-dien
Teraz nie przestawaj... Po reklamie jest więcej ;)
W reakcja Dielsa-Aldera, jeden z odczynników to sprzężony dien, a drugi to związek organiczny, który może występować telefon dwukrotnie między atomami węgla. Poniżej znajduje się przykład Reakcja Dielsa-Aldera między but-2,3-dienem i propenem:
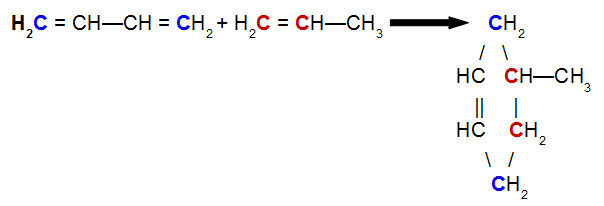
Równanie reakcji Dielsa-Aldera but-2,3-dienu z propenem
Analizując powyższe równanie, widzimy, że węgle 1 i 4 (oba w kolorze niebieskim) wiązania but-2,3-dienowego odpowiednio do węgli 1 i 2 (oba czerwone) propenu, dając początek rozgałęzionemu cyklenowi, 4-metylocykloheksen. Wynika to z rezonansu w cząsteczce but-2,3-dienu, który przesuwa wiązanie pi między węglami 2 i 3 oraz zerwaniem wiązania pi między węglami 1 i 2 propenu.
OBS.²: Należy podkreślić, że niezależnie od związku, który reaguje ze sprzężonym alkadienem, zerwanie wiązania pi nastąpi tylko między atomami węgla w łańcuchu. Jeśli struktura ma wiązania pi między atomami innymi niż węgiel, nie zostaną one zerwane. Poniżej znajduje się przykład struktury, która może reagować z a alkadien w Reakcja Dielsa-Aldera, co powoduje zerwanie wiązania pi między węglami (na niebiesko) wiązania podwójnego.
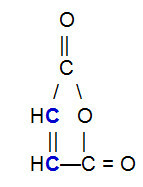
Wzór strukturalny bezwodnika maleinowego
Przeze mnie Diogo Lopes Dias
Czy chciałbyś odnieść się do tego tekstu w pracy szkolnej lub naukowej? Popatrz:
DNI, Diogo Lopes. "Reakcje Dielsa-Aldera"; Brazylia Szkoła. Dostępne w: https://brasilescola.uol.com.br/quimica/reacoes-diels-alder.htm. Dostęp 28 czerwca 2021 r.
Chemia

Alkeny, gaz, eten, etylen, tworzywa sztuczne, kauczuk syntetyczny, barwniki, tkaniny syntetyczne, materiały wybuchowe, kraking naftowy, polietylen, oleje, olefiny, węglowodory, łańcuch, acykliczny dwutlenek węgla.