Alotropia to właściwość polegająca na tym, że pewne pierwiastki chemiczne muszą tworzyć różne proste substancje, to znaczy substancje utworzone tylko przez jeden rodzaj pierwiastka.
Powstające różne substancje są nazywane kształty lub odmiany alotropowe lub z alotropy.
Te alotropy mogą się różnić z dwóch głównych powodów, którymi są:
1. Jego tomiczność: liczba atomów tworzących cząsteczkę;
2. Struktura: Układ atomów w sieci krystalicznej jest inny dla każdej postaci alotropowej.
Siarka (S) to pierwiastek o największej różnorodności form alotropowych, w tym molekuł S2, S4, S6i s8, które różnią się liczbą atomów w każdej cząsteczce. Wszystkie te alotropy siarki można znaleźć w miejscach narażonych na erupcje wulkaniczne, w temperaturach od 444,6°C do 1000°C. Jednak powyżej 1000 °C S2 zaczyna dysocjować na atomową siarkę (S0).
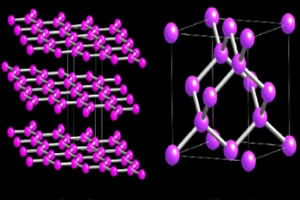
Jednak najważniejsze alotropy siarki to dwa: o siarka rombowa to jest siarka jednoskośna.
Oba mają ten sam wzór cząsteczkowy, s8, różnica między nimi polega na przestrzennym rozmieszczeniu atomów w sieci krystalicznej.

Jak widać na poniższym obrazku, rombowa siarka ma postać żółtych i przezroczystych kryształów, podczas gdy jednoskośna ma kształt igły i jest nieprzezroczysta:

Teraz nie przestawaj... Po reklamie jest więcej ;)
Pomiędzy tymi dwiema alotropowymi formami siarki rombowy jest najczęstszy. Ma gęstość równą 2,07 g/cm3 w 20 °C, temperatura topnienia równa 112,8 °C i temperatura wrzenia równa 444,6 °C.
Jednoskośna ma gęstość 1,96 g/cm3 w temperaturze 20 °C temperatura topnienia równa 119 °C i taka sama temperatura wrzenia jak siarka rombowa. W warunkach otoczenia oba są żółtym proszkiem, bezwonny, nierozpuszczalny w wodzie i bardzo rozpuszczalny w siarczku węgla (CS2).

Siarka ma kilka zastosowań przemysłowych, z których głównym jest produkcja kwasu siarkowego, H2TYLKO4, który z kolei jest szeroko stosowany w produkcji różnych produktów. Ze względu na jego znaczenie gospodarcze, spożycie kwasu siarkowego może często wskazywać na stopień rozwoju kraju.
Innym ważnym zastosowaniem siarki jest wulkanizacja gumy, która polega na dodawaniu od 2 do 30% siarki do gumy pod ogrzewanie i w obecności katalizatorów tworzące trójwymiarowy polimer, z siarką pełniącą funkcję pomostu między łańcuchami węglowy. Dzięki temu kauczuk naturalny jest bardziej wytrzymały i elastyczny, gotowy do różnych zastosowań, takich jak produkcja opon.
Siarka jest również wykorzystywana do produkcji czarnego proszku, insektycydów, kosmetyków i farmaceutyków, takich jak antybiotyki na bazie sulfamidów.
* Kredyty redakcyjne obrazu: emran / Shutterstock.com
Jennifer Fogaça
Absolwent chemii
Czy chciałbyś odnieść się do tego tekstu w pracy szkolnej lub naukowej? Popatrz:
FOGAÇA, Jennifer Rocha Vargas. „Alotropia siarki”; Brazylia Szkoła. Dostępne w: https://brasilescola.uol.com.br/quimica/alotropia-enxofre.htm. Dostęp 28 czerwca 2021 r.
Chemia
Czym jest alotropia, proste substancje, tlen gazowy, ozon, formy alotropowe, tlen pierwiastkowy, promienie ultrafioletowe od słońca, diament, grafit, atomowość, biały fosfor.

