Kiedy poddajemy różne elementy działaniu płomienia, zauważamy, że każdy z nich emituje inny kolor. Na przykład, jeśli spalimy sól strontu, sodu i miedzi, zobaczymy odpowiednio kolory czerwony, intensywny żółty i zielony, jak pokazano na poniższym rysunku:

Jeśli światło z tych płomieni pada na pryzmat, widmo nieciągłe, to znaczy, że będzie obserwowanych tylko kilka kolorowych jasnych linii przeplatanych obszarami bez światła. Dla każdego elementu będziemy mieli inne spektrum.

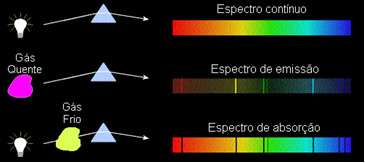
Tego typu widma są nazywane spektrum emisji, ponieważ zostały wydane przez pewien element i służą do jego identyfikacji.
Takie widma można uzyskać za pomocą wiązki światła wytwarzanej w rurze wyładowczej przy wysokiej temperatury i niskiego ciśnienia, zawierające gazy z niektórych pierwiastków, takie jak wodór, lub jako gazy szlachetne noble poniżej:

Przepuszczając to promieniowanie elektromagnetyczne (światło) wytwarzane przez pryzmat, uzyskuje się widma emisyjne każdego z tych pierwiastków.
Wcześniej sądzono, że uzyskane widmo słoneczne jest całkowicie ciągłe, ale angielski naukowiec William Hyde Wollaston odkrył, że pracując z bardzo wąską wiązką światła, ze szczeliną około 0,01 mm widać było, że widmo słoneczne zawierało siedem czarnych linii o tym. Później młodzi
Józefa Fraunhofera (1787-1826), używając pryzmatów i siatek dyfrakcyjnych, odkryli, że widmo słoneczne faktycznie zawiera tysiące nałożonych na siebie czarnych linii.Jakiś czas później fizyczne Gustav Robert Kirchhoff zauważył, że żółte plamki, uzyskane przez widmo sodu, znajdują się dokładnie w tym samym miejscu, co dwie czarne linie w widmie Słońca. on i chemik Robert Wilhelm Bunsen przeprowadził kilka eksperymentów i zauważył, że jeśli białe światło z palnika Bunsena, takie jak światło słoneczne, przechodziło przez żółte światło emitowane przez sód i pryzmat został przekroczony, aby wygenerować widmo; rezultatem byłoby ciągłe widmo słoneczne w kolorach tęczy, ale z czarnymi liniami (zwanymi przez Fraunhofera liniami D) w tej samej pozycji co żółte linie w widmie sodu.
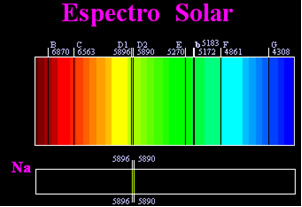
Słońce emituje światło we wszystkich kolorach, od czerwonego do fioletowego, jednak podczas przechodzenia przez ziemską atmosferę obecne gazy pochłaniają światło słoneczne dokładnie w tych kolorach, które emitują.
Tego typu widma są nazywane widma absorpcyjne.
Na podstawie tych obserwacji Kirchoff stworzył trzy prawa do spektroskopii, które są:
1) Ciało nieprzezroczysty gorąco, w dowolnym z trzech stanów fizycznych, emituje widmo ciągły.
2) Gaz przezroczysty – podobnie jak gazy szlachetne, które widzieliśmy powyżej – wytwarza spektrum emisji, o wyglądzie linie jasny. Liczba i położenie tych linii będzie zdeterminowane przez pierwiastki chemiczne obecne w gazie.
3) Jeśli widmo ciągłe przechodzi przez gaz w najniższej temperaturze zimny gaz powoduje obecność ciemne linie, to jest widmo absorpcji. Tak stało się z widmem światła słonecznego przechodzącego przez gaz sodowy. W tym przypadku liczba i położenie linii w widmie absorpcyjnym zależą również od pierwiastków chemicznych obecnych w gazie.
Jennifer Fogaça
Absolwent chemii
Źródło: Brazylia Szkoła - https://brasilescola.uol.com.br/quimica/espectros-emissao-absorcao-leis-kirchhoff.htm
