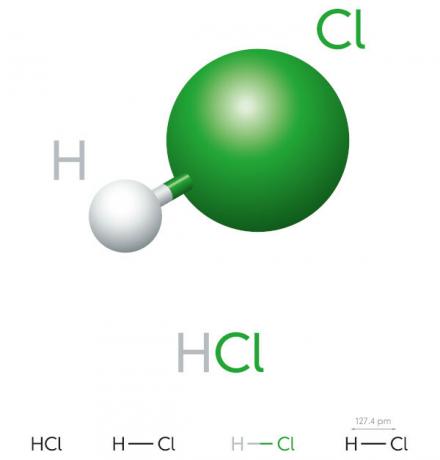
Kwas chlorowodorowy jest kwasem wodorotlenowym o wysokim potencjale jonizacyjnym, jest żółtawą cieczą, silnie żrącą i toksyczną. Znajduje zastosowanie w różnych procesach przemysłowych, takich jak produkcja środków czyszczących i chlorowodorków farmaceutycznych, w przemyśle spożywczym i stalowniczym.
Jest również obecny w ludzkim organizmie; O sok żołądkowy który działa w trawieniu białka jest roztworem kwasu; chlorowodoru i innych substancji, takich jak enzymy i sole. Narażenie, wdychanie lub połknięcie Stężony kwas solny jest bardzo szkodliwy dla zdrowia, co może nawet spowodować śmierć.
Przeczytaj też: Kwas siarkowy – substancja o dużej sile korozyjnej
Właściwości kwasu solnego
- związek nieorganiczny
- mocny kwas
- Wysoki potencjał jonizacyjny
- Ciekły
- żółtawy wygląd
- Toksyczny
- Żrący
- Lotny
- Higroskopijny (ma tendencję do wchłaniania) áwoda środowiska)
- Rozpuszczalny w wodzie
Teraz nie przestawaj... Po reklamie jest więcej ;)
Produkcja kwasu solnego
Kwas solny był odkryty przez muzułmańskiego alchemika zwany Jabir Ibne Haiane, znany również jako Gaber i uważany za ojca arabskiej chemii. Zsyntetyzował substancję w oparciu o reakcja między solą morską (NaCl) a Kwas Siarkowy (W2TYLKO4).
2NaCl + H2TYLKO4 → W2TYLKO4 + 2HCl
Obecnie kwas solny jest produkowany na dużą skalę poprzez elektronicznyóLiza chlorku sodu w roztworze wodnym. Z tego procesu uzyskuje się gaz chlor (Cl2), gaz wodór (H2) i wodorotlenek sodu (NaOH). Gazy chloru i wodoru reagują, tworząc kwas chlorowodorowy:
Cl2 + H2 → 2HCl
Jednak, ta reakcja jest ekstremalna egzotermiczny i bardzo niebezpieczne. Obecnie większość kwasu solnego produkowanego przemysłowo wiąże się z produkcją związków organicznych, będąc procesem bardziej ekonomicznym i bezpieczniejszym.
R-H + Cl2 → R-Cl + HCl
(Uważaj, że R jest rodnikiem organicznym.)
Zobacz też: Wskazówki do ustalenia-gdyby siła kwasów

Aplikacja kwasu solnego
- Trawienie metali: Kwas solny służy do „oczyszczania” metali przed ich obróbką, usuwania rdzy, zgorzeliny i innych zanieczyszczeń z ich powierzchni.
- Produkcja związków organicznych: kwas solny służy jako odczynnik do otrzymywania chlorku winylu, który jest wykorzystywany w produkcji tworzyw sztucznych. Kwas solny również pochodzi z chloroprenu, który jest używany w kauczukach syntetycznych.
- Produkcja związków nieorganicznych: kwas solny jest obecny w kilku przemysłowych procesach wytwarzania odczynników i związków nieorganiczne, wśród nich produkty do uzdatniania wody, takie jak chlorek żelaza(III) i aluminium.
- Stosowany jako środek czyszczący: Sprzedawany również jako kwas murianowy, kwas solny jest używany do pokonstrukcyjnego, domowego i chemicznego czyszczenia narzędzi i maszyn.
- Przetwórstwo spożywcze: Kwas solny jest stosowany w różnych reakcjach do produkcji żywności i dodatków, takich jak hydroliza skrobi i białek lub w produkcie końcowym do zrównoważenia pH.
- Produkcja leków: Kwas solny jest wykorzystywany do produkcji rozpuszczalnych chlorowodorków obecnych w kilku lekach, takich jak chlorowodorek doksycykliny, stosowany w leczeniu dur brzuszny i ospa.
Kwas solny w organizmie
Kwas solny jest obecny w naszym układ trawienny, sok żołądkowy wytwarzany przez nasz żołądek to roztwór wody, enzymów, kwasu solnego, soli nieorganicznych i niewielkiego procentu kwasu mlekowego.
O ciasto spożywcze zamienia się w chyme, masa kwasowa (dzięki działaniu soku żołądkowego i jego kwaśnemu składowi), to wtedy trawienie białka, zamienił się w polipeptydy i aminokwasy które zostaną wchłonięte przez organizm.
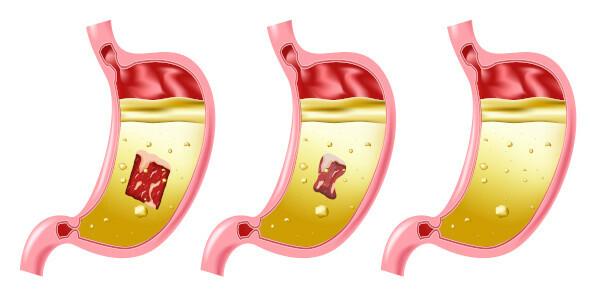
Zagrożenia związane z kwasem solnym
Kwas solny jest bardzo silnym i żrącym kwasem, dlatego kontakt z substancją powoduje szereg uszkodzeń:
- Skóra: Powoduje oparzenia i podrażnienia.
- Oczy: Powoduje poważne podrażnienie i może spowodować ślepotę.
- Inhalacja: Powoduje podrażnienie i uszkodzenie górnych dróg oddechowych.
- przyjmowanie pokarmu: powoduje korozję w całej jamie ustnej, aw przewodzie pokarmowym może powodować wymioty, krwawienie, biegunkę, problemy z krążeniem, które mogą prowadzić do śmierci.
- Narażenieciąg dalszy nastąpi: najpierw atakuje błony śluzowe, powodując zapalenie skóry ider zapalenie spojówekkrwawiące dziąsła, fotouczulanie; częste wdychanie, nawet przy niskim stężeniu związku, może powodować nieżyt żołądka i krwawienia z nosa.
Również dostęp: Charakterystyka i właściwości kwasu octowego

rozwiązane ćwiczenia
Pytanie 1 - (Udesc) W odniesieniu do kwasu solnego można stwierdzić, że:
A) w roztworze wodnym umożliwia przepływ prądu elektrycznego.
B) jest dikwasem.
C) jest słabym kwasem.
D) ma niski stopień jonizacji.
E) jest substancją jonową.
Rozkład
Alternatywa A. Kwas solny nie jest dikwasem, ponieważ zawiera tylko jeden jonizowalny H, ale jeden mocny kwas, substancja molekularna o wysokim potencjale jonizacyjnym. TEN jonizacja w środowisku wodnym wspomaga przewodzenie prąd elektryczny ze względu na istnienie wolnych jonów.
Pytanie 2 - W roztworze kwasu solnego i wody możemy powiedzieć, że występowanie cząsteczkowego chlorowodoru (HCl) jest minimalne, ponieważ
A) kwas solny w kontakcie z wodą rozcieńcza się.
B) chlorowodór jest substancją, która nie rozpuszcza się w wodzie.
C) chlorowodór ma wysoki potencjał jonizacyjny, dlatego w środowisku wodnym cząsteczka HCl tworzy jony H+ Cl-.
D) kwas solny, będąc bardzo lotny, oddziela się od roztworu, pozostawiając tylko cząsteczki wody.
E) kwas solny jest substancją jonową, dlatego w roztworze wodnym dysocjuje, tworząc jony.
Rozkład
Alternatywa C.
A) Odpowiedź nie zgadza się z pytaniem, rozcieńczanie kwasu solnego w wodzie nie uzasadnia braku cząsteczkowego HCl.
B) Nieprawidłowo, chlorowodór jest rozpuszczalny i ma powinowactwo do wody.
C) Prawidłowo
D) Chociaż kwas chlorowodorowy jest lotny, ta segregacja dwóch związków w roztworze nie występuje znacząco.
E) Kwas solny jest roztworem chlorowodoru i wody, gdzie chlorowodór jest niejonową substancją molekularną.
Laysa Bernardes Marques de Araujo
Nauczyciel chemii
Czy chciałbyś odnieść się do tego tekstu w pracy szkolnej lub naukowej? Popatrz:
ARAúJO, Laysa Bernardes Marques de. "Kwas chlorowodorowy"; Brazylia Szkoła. Dostępne w: https://brasilescola.uol.com.br/quimica/Acido-cloridrico.htm. Dostęp 27 czerwca 2021 r.