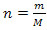W procesach izowolumetrycznych objętość pozostaje stała i dlatego nie wykonuje się żadnej pracy. Ciepło wymieniane z medium jest równe zmianie energii wewnętrznej układu (patrz wykres powyżej).
Zgodnie z pierwszą zasadą termodynamiki w każdym procesie termodynamicznym ilość ciepła Q otrzymana przez system jest równa wykonanej przez niego pracy plus zmienność jego energii wewnętrznej. Dlatego równanie reprezentujące pierwsze prawo jest następujące:
Q=τ+∆U
Jak stwierdzono w pierwszym akapicie, gdzie jest napisane, że nie ma pracy, musimy τ=0. Zatem ciepło wymieniane z medium jest równe przyrostowi energii wewnętrznej układu. Mamy więc:
Teraz nie przestawaj... Po reklamie jest więcej ;)
Q=∆U
Kiedy ciepło jest dostarczane do systemu, to znaczy kiedy Q jest pozytywny, energia wewnętrzna wzrośnie; i kiedy system traci ciepło, czyli kiedy Q jest ujemna, energia wewnętrzna zmniejszy się. Procesy o stałej objętości występują, gdy pojemnik zawierający materiał jest sztywny (np. butla gazowa).
Podczas odbierania ciepła system ma tendencję do rozszerzania się, ale utrudniają go ściany naczynia, przez co wzrasta ciśnienie i temperatura systemu.
Autor: Domitiano Marques
Ukończył fizykę
Czy chciałbyś odnieść się do tego tekstu w pracy szkolnej lub naukowej? Popatrz:
SILVA, Domitiano Correa Marques da. „Pierwsze prawo dla procesów izowolumetrycznych”; Brazylia Szkoła. Dostępne w: https://brasilescola.uol.com.br/fisica/primeira-lei-para-processos-isovolumetricos.htm. Dostęp 27 czerwca 2021 r.