En reversibel reaksjon det skjer når det er mulig å transformere produktene tilbake til reaktantene. Denne typen reaksjon kommer inn kjemisk balanse når utviklingshastigheten til den direkte reaksjonen, det vil si reaksjonen med forbruk av reagenser og dannelse av produkter skjer i samme hastighet som omvendt reaksjon - dannelse av reaktanter og forbruk av produkter.
Disse typene balanserte reaksjoner sees mye i hverdagen. Et eksempel er hva som skjer i huler, i dannelsen av såkalte stalaktitter og stalagmitter.
Grunnvann er utsatt for høyt trykk, så det inneholder store mengder karbondioksid (CO2 (g)) oppløst i den. Når du går gjennom jord som inneholder kalkstein (CaCO3 (r)), dette karbonatet oppløses og huler dannes, i henhold til reaksjonen nedenfor:
CaCO3 (r) + CO2 (g) + H2O(1) → Ca2+(her) + 2 HCO-3 (aq)
Imidlertid kan karbonat- og kalsiumioner reagere og utfelle på nytt som kalsiumkarbonat. Dette demonstreres av reaksjonen:
Her2+(her) + 2 HCO-3 (aq)→ CaCO3 (r) + CO2 (g) + H2O(1)
Ikke stopp nå... Det er mer etter annonseringen;)
Som du kanskje har lagt merke til, er en reaksjon akkurat det motsatte av den andre: reaktanter blir produkter og produkter blir reaktanter. Så vi kan representere denne reaksjonen i balanse som følger:
CaCO3 (r) + CO2 (aq) + H2O(1) Her2+(her) + 2 HCO-3 (aq)
Her2+(her) + 2 HCO-3 (aq)
Den langsomme og kontinuerlige disponeringen av karbonat fra mineraliserte dråper fra taket til hulene løper ned, vannet deres fordamper og det frigjøres CO2. Slik at den kjemiske balansen forskyves i motsatt retning (for dannelse av reagenser), derav CaCO3 (r) er dannet, det vil si den stalaktitter på taket av hulene. Når det faller, har dråpen fortsatt løst opp karbonatet, som er avsatt på hulegulvet, og danner stalagmitter.
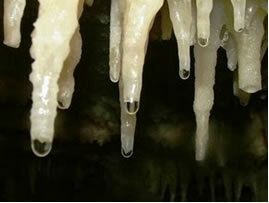
Vann med kalkstein drypper for dannelse av stalaktitter og stalagmitter
Av Jennifer Fogaça
Uteksamen i kjemi
Vil du referere til denne teksten i et skole- eller akademisk arbeid? Se:
FOGAÇA, Jennifer Rocha Vargas. "Kjemisk balanse i hulene"; Brasilskolen. Tilgjengelig i: https://brasilescola.uol.com.br/quimica/equilibrio-quimico-nas-cavernas.htm. Tilgang 28. juni 2021.