DE aktiveringsenergi det er den minste energimengde som er nødvendig for at kollisjonen mellom reaktantpartiklene, laget i en gunstig retning, skal finne sted og resultere i en reaksjon.
Reaksjoner oppstår bare når reaktantene har aktiveringsenergi (eller det minimale behovet for energi, som varierer fra reaksjon til reaksjon; enten i mengde eller form) eller når den leveres til dem.
For eksempel når metallisk natrium kommer i kontakt med vann, reagerer det voldsomt. Dette betyr at energiinnholdet i disse reaktantene allerede er tilstrekkelig for at reaksjonen skal finne sted.
Når du slår på en komfyr, vil forbrenningsreaksjonen bare skje hvis vi plasserer en tent fyrstikk eller en annen ildkilde i nærheten av gassen som frigjøres av ovnen. Dette betyr at det i dette tilfellet var nødvendig å levere energi til systemet slik at det nådde aktiveringsenergien og reaksjonen fant sted.
Når det gjelder selve fosforet, for å forbrenne, tilveiebringes aktiveringsenergien av friksjon. Det samme skjer med lightere, som også trenger en gnist som gir den nødvendige aktiveringsenergien for forbrenningen av gassen i dem.
Aktiveringsenergi kan også tilveiebringes av lys, slik det er tilfellet med spaltning av hydrogenperoksid. Derfor lagres den i mørke eller ugjennomsiktige flasker.
Ikke stopp nå... Det er mer etter annonseringen;)

Dermed kan vi konkludere med at aktiveringsenergien (E.før) er forskjellen mellom energien som trengs for at reaksjonen skal starte (E) og energien som finnes i reaktantene (E.pr):

Aktiviseringsenergi er et hinder for at reaksjonen skal finne sted, og det er nødvendig å bryte båndene til reaktanter. Med dette skjer reaksjonen og nye forbindelser blir laget for å danne produktene.
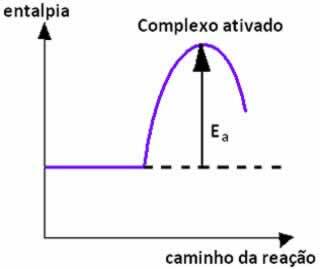
Når kollisjonen mellom partikler av reaktanter med gunstig orientering skjer med lik eller høyere enn aktiveringsenergien, før dannelsen av produktene dannes en mellomliggende og ustabil tilstand, pålydende aktivert kompleks, hvor reaktantbindingene er svekket og produktbindingene blir dannet. Og dermed, aktiveringsenergi er energien som trengs for å danne det aktiverte komplekset.
Nedenfor har vi en graf som viser aktiveringsenergien som en barriere for at reaksjonen skal finne sted:
Av Jennifer Fogaça
Uteksamen i kjemi
Vil du referere til denne teksten i et skole- eller akademisk arbeid? Se:
FOGAÇA, Jennifer Rocha Vargas. "Aktiveringsenergi"; Brasilskolen. Tilgjengelig i: https://brasilescola.uol.com.br/quimica/energia-ativacao.htm. Tilgang 27. juni 2021.


