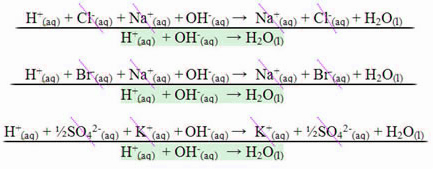En bufferløsning er en blanding som brukes for å forhindre at pH eller pOH i mediet endres når sterke syrer eller sterke baser tilsettes.
Det er to typer bufferløsninger:
1. Blanding av svak syre med konjugatbase;
2. Blanding av svak base med konjugat syre.
La oss se på eksempler på hver og hvordan de fungerer når en liten mengde sterk syre eller base tilsettes mediet:
1. Blanding av svak syre med konjugatbase:
For å danne en slik løsning blandes den svake syren med et salt av samme anion som syren.
Tenk for eksempel på en bufferløsning som består av eddiksyre (H3CCOOH(her)) og natriumacetat (H3CCOONa(s)). Se at begge har acetatanionet: (H3CCOO-(her)). Konsentrasjonen av disse ionene skyldes praktisk talt dissosiasjonen av saltet, som er stort. Syreioniseringen er liten.

Legg merke til hva som skjer i følgende tilleggsmuligheter:
- Tilsetning av en liten mengde sterk syre:
Tilsetningen av en sterk syre øker konsentrasjonen av hydroniumionen, H3O+1og siden eddiksyre er en svak syre, har acetatanionen en høy affinitet for protonet (H
+hydronium. På denne måten reagerer de og det dannes mer eddiksyre:
Som et resultat endres pH i mediet praktisk talt ikke. Imidlertid, hvis mer og mer sterk syre tilsettes, vil tiden komme når hele acetatanionen vil bli konsumert og buffereffekten vil opphøre.
- Tilsetning av en liten mengde sterk base:
Tilsetningen av en sterk base øker konsentrasjonen av OH-ioner-. Men disse ionene blir nøytralisert av H-ionene3O+1 frigjort ved ionisering av eddiksyre:

Med denne reaksjonen, konsentrasjonen av H-ioner3O+1(her) vil avta og det vil være en forskyvning av likevekten i form av å øke syreioniseringen, og derfor vil pH-variasjonen av løsningen være veldig liten. Konsentrasjonen av H-ioner3O+1(her) det vil være praktisk talt konstant.
Ikke stopp nå... Det er mer etter annonseringen;)
I dette tilfellet er det også en begrensningskapasitet. Derfor, hvis vi tilfører mer og mer base, vil balansen mellom syreionisering forskyves mer og mer mot ionisering, til all syren er forbrukt.
2. Blanding av en svak base med dens konjugatsyre:
Denne typen bufferløsning består av en svak base og en saltløsning som inneholder samme kation som basen.
Tenk for eksempel på en bufferløsning dannet av magnesiumhydroksid, MgOH2 (aq) (svak base) og magnesiumklorid, MgCl2 (r) (salt). Begge inneholder kationet magnesium (Mg2+(her)). Magnesiumionene i mediet er praktisk talt alle avledet fra dissosiasjonen av saltet, da dissosiasjonen av basen er svak:
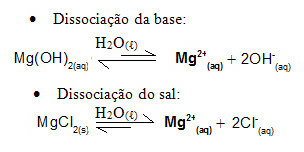
- Tilsetning av en liten mengde sterk syre:
I dette tilfellet er H-ionene3O+1 kommer fra tilsetning av sterk syre vil bli nøytralisert av OH-ioner-, kommer fra svak base dissosiasjon. Dette vil flytte basedissosiasjonsbalansen til høyre.
Dermed vil pH-variasjonen (hvis noen) være veldig liten, fordi konsentrasjonen av OH-ioner- forblir konstant. Buffereffekten vil opphøre når hele basen blir dissosiert.
- Tilsetning av en liten mengde sterk base:
Den tilførte sterke basen gjennomgår dissosiasjon og frigjør OH-ioner-. Siden magnesiumhydroksyd er en svak base, vil magnesiumet som frigjøres ved dissosiasjon fra saltet, ha en større tendens til å reagere med OH-:

Derfor økningen i OH-ioner- motvirkes av proporsjonal økning i Mg (OH)2 (aq). Som et resultat gjennomgår pH ikke store endringer.
Denne effekten ender når alt magnesiumkation er konsumert.
Av Jennifer Fogaça
Uteksamen i kjemi
Vil du referere til denne teksten i et skole- eller akademisk arbeid? Se:
FOGAÇA, Jennifer Rocha Vargas. "Hva er en bufferløsning?"; Brasilskolen. Tilgjengelig i: https://brasilescola.uol.com.br/quimica/o-que-uma-solucao-tampao.htm. Tilgang 28. juni 2021.
Kjemi

Test din kunnskap og lær mer med denne listen over løste øvelser om kjemiske balanser. Gjennom dette materialet vil du være i stand til å bedre forstå hvordan man arbeider likevektskonstanter (Kp, Kc og Ki), likevektsskift, pH og pOH, samt likevekt i såkalte bufferløsninger.
Løsning, fast løsning. Flytende løsning, gassløsning, løsninger dannet av gass og væske, løsninger dannet av væsker.