det kjemiske elementet fosfor (P) tilhører den tredje perioden av det periodiske systemet og til Nitrogen (VA) -familien. Av denne grunn utgjør atomer normalt tre kjemiske bindinger å nå oktettteori (stabilitet). Imidlertid er det noen situasjoner der et fosforatom danner mer enn tre bindinger, et faktum som bare er mulig gjennom hybridiseringsfenomen.
For å forstå fosfor hybridisering, Vi må først forstå hvorfor atomet til dette elementet lager tre bindinger. For å gjøre dette trenger vi bare å overvåke den elektroniske distribusjonen din:

Elektronisk fosforfordeling
Vi kan observere at fosforatomet i valenslaget har det fullstendige 3-nivået (med to elektroner) og det ufullstendige 3p subnivå (hver av de tre p subnivå orbitalene har en elektron). Nedenfor har vi fordelingen av elektronene i orbitalene til undernivåene til Fosforvalenslag:
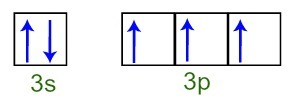
Representasjon av valensskallelektronene til fosforatomet
Ettersom hver av 3p orbitalene i subnivå er ufullstendige, er fosforatomet i stand til å lage tre kjemiske bindinger, og oppnår dermed stabilitet.
Nå når vi ser på stoffet PCl5for eksempel er vi sikre på at fosforet i dette molekylet gjennomgikk hybridisering, ettersom det gjorde fem forbindelser. Ettersom klor, som tilhører VIIA-familien, trenger en binding for å være stabil, og molekylet har fem atomer av dette element, må hver av dem lage en binding, noe som gjør at fosforatomet i sin tur også må lage fem Tilkoblinger. Denne forekomsten er bare mulig gjennom hybridisering (forening av ufullstendige atomorbitaler) av fosfor.
Ikke stopp nå... Det er mer etter annonseringen;)
Når du mottar energi fra det ytre miljøet, blir elektronene til fosforatomet begeistret. Rett etter beveger en av de to elektronene som tilhører 3s-undernivået til en tom bane som er tilstede i d-undernivået, som til da ikke har noen elektroner. Se diagrammet nedenfor:
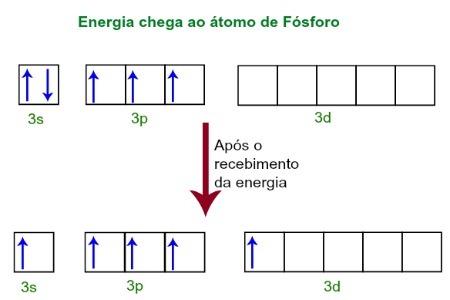
Ved mottak av energi blir fosforelektronene begeistret, og man opptar en bane av undernivået.
For øyeblikket har vi i fosforets valenslag en orbital, tre p-orbitaler og en ufullstendig orbital.Til slutt hybridiserer disse fem orbitalene, det vil si fusjonere, noe som resulterer i fem ufullstendige atomorbitaler, som nå er i stand til å lage fem kjemiske bindinger.

Hybridisering av ufullstendige atomorbitaler av fosfor
Som en s bane, tre p orbitaler og en d orbital ble sammenføyet, er fosfor hybridisering av typen sp3d.
Av meg. Diogo Lopes Dias
Vil du referere til denne teksten i et skole- eller akademisk arbeid? Se:
DAGER, Diogo Lopes. "Hybridisering av fosfor"; Brasilskolen. Tilgjengelig i: https://brasilescola.uol.com.br/quimica/hibridizacao-fosforo.htm. Tilgang 28. juni 2021.

