geometrisk isomer er en slags romisomerisme som evaluerer og sammenligner posisjonen i rommet til ligandene til to karbonatomer i en kjede. Denne evalueringen er laget fra et tenkt plan mellom de involverte karbonene.
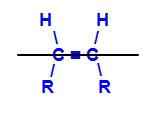
Imaginært plan som deler molekylet
Det imaginære planet i strukturen over deler molekylet i et øvre plan og et nedre plan. Med dette kan vi evaluere og sammenligne karbonligandene som er involvert i hvert av disse planene. Se typene geometriske isomerer:
→ Cis-trans geometrisk isomer
En forbindelse har cis-trans geometrisk isomerisme når kjeden viser:
Åpen kjetting med dobbeltbinding mellom to karbonatomer, som har de samme koblingene til hverandre. Se et eksempel:
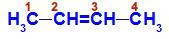
Strukturformel av But-2-en
I strukturen kan vi observere at både karbon 2 og karbon 3 har samme ligander, som er hydrogen (H) og metyl (CH3).
Lukket kjede med to karbonatomer som har samme ligander til hverandre. Se et eksempel:
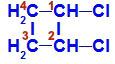
Strukturformel av 1,2-diklor-cyklobutan
I strukturen kan vi observere at både karbon 1 og karbon 2 har samme ligander, som er hydrogen (H) og klor (Cl).
For å forklare cis-trans isomerisme, vil vi bruke but-2-en:
a) Cis-isomer: er den geometriske isomeren der de samme ligandene opptar samme plan. I eksemplet nedenfor er hydrogenene i samme plan, som metylradikaler.

Strukturformel av cis-but-2-en
b) Trans-isomer: er den geometriske isomeren der forskjellige ligander opptar samme plan. I eksemplet nedenfor har vi på samme plan et hydrogen og en metyl (CH3).
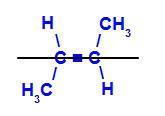
Strukturell formel for trans but-2-en
Ikke stopp nå... Det er mer etter annonseringen;)
→ E-Z geometrisk isomer
En forbindelse har E-Z geometrisk isomerisme når kjeden har:
Åpen kjede med dobbeltbinding mellom to karbonatomer, som har alle eller noen forskjellige koblinger. Se et eksempel:
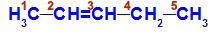
Strukturformel av pent-2-en
I strukturen kan vi se at karbon 2 har metylliganden (CH3) og hydrogen (H), og karbon 3 har hydrogen (H) og etyl (H) ligand3C-CH2).
Lukket kjede med to karbonatomer som har alle eller noen ligander som er forskjellige fra hverandre. Se et eksempel:
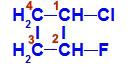
Strukturformel av 1-klor-2-fluor-cyklobutan
I strukturen kan vi observere at karbon 1 har hydrogen og klor som hovedligander, og karbon 2 har hydrogen og fluor som hovedligander.
MERK: Blant de forskjellige ligandene, i geometrisk isomerisme, vurderer vi ligandens kompleksitet (antall atomer) eller atomnummeret.
For å forklare E-Z-isomeren vil vi bruke både pent-2-en og 1-klor-2-fluor-cyklobutan:
a) E-isomer
geometrisk isomer hvor de mer komplekse ligandene eller de med høyest atomnummer er plassert på motsatte plan. I det følgende eksemplet er den mest komplekse liganden på karbon 2 metyl, og den mest komplekse liganden på karbon 3 er etyl, som er plassert på forskjellige plan.
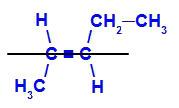
Strukturformel for E-pent-2-en
b) Isomer Z
geometrisk isomer der de mer komplekse ligandene eller de med høyest atomnummer er plassert på samme plan. I det følgende eksemplet er den høyeste atomantallanden av karbon 1 klor (Z = 17), og det høyeste atomnummeret ligand av karbon 2 er fluor (Z = 9), som er plassert i samme plan.
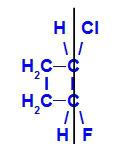
Strukturformel av Z-1-klor-2-fluor-cyklobutan
Av meg. Diogo Lopes Dias
Vil du referere til denne teksten i et skole- eller akademisk arbeid? Se:
DAGER, Diogo Lopes. "Hva er geometrisk isomerisme?"; Brasilskolen. Tilgjengelig i: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-isomeria-geometrica.htm. Tilgang 28. juni 2021.
Kjemi
Vet hva de forskjellige typene plane og romlige isomerer handler om, for eksempel funksjon, posisjon, kjede, tautomerisme, metamerisme, cis-trans geometrisk og optisk isomerisme.