Enzymer er biologiske katalysatorer som er ansvarlige for å øke hastigheten til en gitt kjemisk reaksjon. Enzymer er vanligvis proteiner, men det er noen ribonukleinsyrer som fungerer som enzymer, blir kalt ribozymer.
For å få en raskere reaksjon må enzymer binde seg til reagenser, som er kjent som substrater. I lang tid ble denne lenken antatt å forekomme på en veldig stiv måte, et mønster kjent som tastelåsen. for øyeblikket, Derimot, modellen kjent som indusert montering er akseptert., som antar at små endringer oppstår i form av enzymet når substratet kommer inn i det aktive stedet.
Les også: Hva er metabolisme?
Hva er enzymer?
Enzymer er biomolekyler som fungerer som katalysatorer, det vil si de er stoffer som kan akselerere hastigheten på kjemiske reaksjoner som forekommer i levende vesener uten å bli fortært under disse reaksjonene. Uten virkningen av enzymer ville noen reaksjoner være veldig sakte, noe som ville skade stoffskiftet. Enzymer akselererer selektivt reaksjoner og er derfor veldig spesifikke katalysatorer.
Enzymer er i stand til å øke hastigheten på en reaksjon ved å redusere aktiveringsenergien, det vil si at de reduserer mengden energi som må tilsettes for at en reaksjon skal starte.
[publikasjon_omnia]
Er hvert enzym et protein?
Selv om de ofte defineres som biologiske katalysatorer av protein-karakter, ikke hvert enzym er et protein. Det er noen RNAer som fungerer som enzymer, kalt ribozymer. De fleste enzymer er imidlertid proteiner som blir dannet av aminosyrer. Aminosyresammensetningen til disse biomolekylene definerer den tredimensjonale strukturen den vil tilegne seg.
Les også: Hvordan fungerer katalysatorstoffer?
Enzym-substratkompleks
Det kalles reagenssubstratet som et enzym virker på. Når et enzym binder seg til substratet, dannes komplekset enzym-substrat. Denne bindingen finner sted i en bestemt region, kalt det aktive nettstedet.
Når vi snakker om proteinbaserte enzymer, tilsvarer det aktive stedet bare noen få aminosyrer, mens resten av molekylet er ansvarlig for å bestemme konfigurasjonen av det aktive stedet. Formen på det aktive stedet så vel som substratets form er relatert til enzymets spesifisitet, da de må være komplementære.
Tastelås-modell
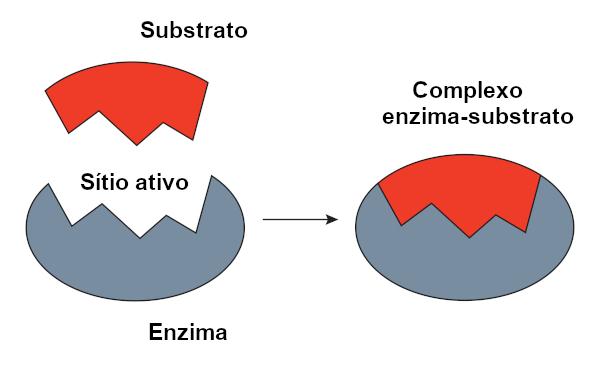
O nøkkellås-modell, foreslått av Emil Fischer, er mye brukt for å forklare interaksjonen mellom enzym og substrat. I følge denne modellen er det en stiv komplementaritet mellom enzymet og substratet, akkurat som en nøkkel og en lås. Enzymets aktive sted vil ha en komplementær form til substratet, som vil passe perfekt. Andre molekyler ville derfor ikke ha tilgang til dette nettstedet, noe som vil garantere enzymets spesifisitet. Akkurat som en nøkkel bare åpner en lås, ville et enzym bare binde seg til et substrat. I dag vet vi imidlertid at dette modellen er ikke riktig, siden enzymer ikke er stive strukturer som tidligere antatt.
Indusert tilpasningsmodell
For øyeblikket har mest aksepterte modellen for å forklare sammenhengen mellom et enzym og dets substrat er den av snap indusert, opprinnelig foreslått av Koshland et al. Det aktive stedet og underlaget fungerer ikke stivt som en nøkkel og lås. Forskning viser at når substratet kommer inn i det aktive stedet, gjennomgår enzymet en liten modifikasjon, noe som favoriserer passformen mellom det aktive stedet og substratet. For bedre å forstå denne modellen kan vi tenke på enzym- og substratinteraksjonen som et håndtrykk, som blir fastere etter første kontakt.
Kofaktorer
De fleste enzymer trenger hjelpemolekyler for å utføre sin katalytiske virkning, kalt kofaktorer. Kofaktorer kan være permanent festet til enzymet eller kan være svakt og reversibelt festet til substratet. De også kan være uorganisk eller organisk. Når medfaktorer er organiske molekyler, kalles de koenzymer.
Noen vitaminer fungerer som koenzymer, dette er for eksempel tilfellet med riboflavin, også kjent som vitamin B2. Som eksempler på uorganiske medfaktorer kan vi nevne jern og sink i deres ioniske form.
Les også: B-komplekse vitaminer - en gruppe vitaminer som vanligvis fungerer som koenzymer
Enzymklassifisering
Enzymer kan klassifiseres i seks grupper, ved å bruke som kriterium reaksjonstypen de katalyserer.
Oksidoreduktaser: enzymer relatert til reaksjonene til oxirreduksjon.
Overføringer: katalysere overføringen av grupper fra en forbindelse til en annen.
Hydrolaser: katalysere hydrolysereaksjoner.
Liases: handle ved å legge til grupper i dobbeltbindinger eller fjerne grupper som danner en dobbeltbinding.
Isomeraser: katalysere isomeriseringsreaksjoner.
Lenker: enzymer som forårsaker nedbrytning av molekylet i ATPved å bruke energien som frigjøres i denne reaksjonen til å danne nye forbindelser.
Faktorer som regulerer enzymaktivitet
Aktiviteten til et enzym er påvirket av faktorer, de viktigste er temperatur og pH. Temperatur spiller generelt en positiv rolle i kjemiske reaksjoner, og øker hastigheten på en enzymatisk reaksjon. Imidlertid når temperatur øker over de optimale forholdene, faller reaksjonshastigheten betraktelig. Dette er fordi denaturering av proteiner blir observert. De fleste menneskelige enzymer har en optimal temperatur mellom 35 og 40 ºC. I tillegg til temperaturen, er den pH det påvirker også den enzymatiske aktiviteten, og det er også en optimal verdi. For de fleste enzymer er den optimale pH-verdien i området 6 til 8.
Av Vanessa Sardinha dos Santos
Biologilærer

