En energisk oksidasjonsreaksjon i alkener oppstår når det er et brudd på molekylet, det vil si samtidig brytning av de to dobbeltbindinger og oksygeninntak i det organiske molekylet.
Det er mulig å utføre denne typen reaksjon med alkener ved bruk av kaliumpermanganat (KMnO4) eller kaliumdikromat (K2Cr2O7) konsentrert, i et surt medium, mens det er varmt.
I det sure mediet er det H-ioner3O+ forårsaker at KMnO spaltes4 og frigjør 5 atomer med gass oksygen [O] for hver 2 KMnO4. Legg merke til denne nedbrytningen nedenfor:

Denne reaksjonen kalles "energisk" fordi den bryter de to bindinger av dobbelt (i mild oksidasjon er bare bindingen ødelagt pi), er en annen faktor at denne reduksjonen av mangan i et surt medium er mye mer intens enn i et basisk medium, slik det gjøres i mild oksidasjon.
Det nye oksygenet som frigjøres reagerer deretter med et alken, men sluttproduktet avhenger av hva typer karbon som gjør dobbeltbindingen, det vil si om de er primære, sekundære eller tertiær. Se hva som skjer i hvert tilfelle:
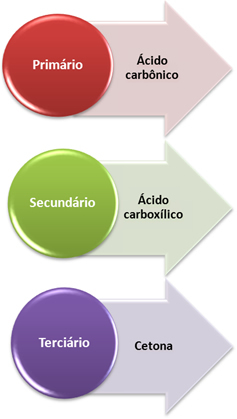
- Primær karbon: Hvis umettingen er mellom to primære karbonatomer, vil de dannede produktene være to karbonsyrer (H2CO3). Hvis bare ett av karbonene i dobbeltbindingen er primært, vil bare ett av molekylene som dannes være karbonsyre. Imidlertid er denne forbindelsen ustabil og har aldri blitt isolert, den brytes ned i vann og karbondioksid.
- Sekundært karbon: Hvis umettingen er mellom to sekundære karbonatomer, vil de to dannede produktene være karboksylsyrer. Hvis bare ett av karbonene er sekundært, vil det gi et karboksylsyremolekyl, mens det andre vil avhenge av det andre karbonet.
- Tertiært karbon: Gir opp til keton.
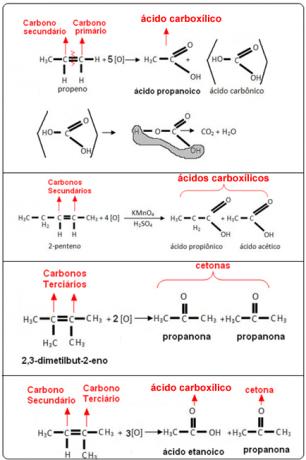
Se følgende eksempler:
Av Jennifer Fogaça
Uteksamen i kjemi
Kilde: Brasilskolen - https://brasilescola.uol.com.br/quimica/oxidacao-energetica-alcenos.htm
