skjer med transformasjonisokorisk når en gitt gassmasse gjennomgår endringer i temperatur som utløser trykkendringer eller omvendt, med tanke på at temperatur og press, i dette tilfellet, er direkte proporsjonale mengder, mens systemvolumet forblir uendret.
Se også: Hva er partielt trykk av gasser?
Hva er en isokorisk transformasjon?
En isokorisk transformasjon er når en endring i temperatur og trykk skjer med en gitt gassmasse, men volumet forblir det samme. Trykkendringen vil være direkte proporsjonal med temperaturen, det vil si at hvis en gass, i et bestemt lukket system, dobler den absolutte temperaturen, vil dette føre til en økning i trykket til det dobbelte av hva den var i utgangspunktet.
Denne typen transformasjon kalles også isovolumetrisk eller isometrisk. Den isokoriske betegnelsen kommer fra gresk Isokhora, på hva iso betyr "lik" og khora betyr "sted eller volum" (i denne sammenheng).
Eksempler:
Dekkene til en bil gjennomgår isokorisk transformasjon, vi kan observere dette når vi lager det
kalibrering. På varme dager er trykket gitt på kalibreringsmonitoren høyere enn på kalde dager. Dette er fordi, med en økning i temperaturen, øker trykket siden volumet forblir.
Andre eksempler er spray deodoranter, i denne typen produkter er det en advarsel på etiketten om ikke å oppbevares eller utsettes for høye temperaturer, fordi, i tillegg til at noen av stoffene er brannfarlige, er det tilstanden for isochorisk transformasjon eller isovolumetrisk. Ettersom aerosoldeodorantene er inne i en forseglet flaske og i gassform, vil en temperaturøkning vil føre til trykkøkning og fare for eksplosjon.
Kjennetegn ved en isokorisk transformasjon
- Konstant volum.
- Trykk og temperatur er direkte proporsjonal.
Disse egenskapene kan beskrives med følgende formler:

Graf over en isokorisk funksjon
Legg merke til følgende tabell som beskriver gassens oppførsel i forhold til trykk, temperatur og den resulterende konstanten.
Temperatur (° C) |
Trykk (atm) |
P / T = konstant |
50 |
5 |
10 |
100 |
10 |
10 |
150 |
15 |
10 |
200 |
20 |
10 |
Merk at trykket følger temperaturstigningen slik at P / T-forholdet forblir konstant, noe som betyr at trykk og temperatur er direkte proporsjonale størrelser. Derfor er grafen som beskriver isokoriske transformasjoner av lineær type. Se:

Hvem oppdaget den isokoriske transformasjonen?
Jacques Alexandre César Charles (1746-1823) var den franske forskeren som studerte gassens oppførsel i et lukket system for å lage et presisjonstermometer og avsluttet studiene om isokoriske transformasjoner.
Vitenskapsmannen Joseph Louis Gay-Lussac (1778-1850) utviklet også en studie om utvidelse og krymping av et gasssystem. Dette var uavhengige analyser, men fordi de kom til samme konklusjon, delte de studiepoengene. I dag refererer noen forfattere til de to siste fysiske lovene om gasser som forklarer isobariske transformasjoner og isokorisk som 1. og 2. lov av Charles-Gay-Lussac.
Se også: Gay-Lussacs volumetriske lov
Øvelserløst
Spørsmål 1 - (PUC-RJ) Et sykkeldekk er kalibrert med et trykk på 4 atm, på en kald dag, ved en temperatur på 7 ° C. Volumet og mengden injisert gass er den samme. Hva vil kalibreringstrykket være i dekket når temperaturen når 37 ° C?
a) 21,1 atm
b) 4,4 atm
c) 0,9 atm
d) 760 mmHg
e) 2,2 atm
Vedtak
Alternativ A
Første trinn: identifiser systemet og trekk ut dataene.
Isovolumetrisk system
P1 = 4 atm
T1 = 7 ° C
T2 = 37 ° C
P2 =?
Ved hjelp av formelen:
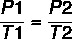
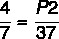
7 x P2 = 37 x 4
P2 = 148/7
P2 = 21,14 atm
Spørsmål 2 - (Unifor-CE) Undersøk figuren nedenfor.
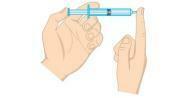
Gasstrykket inne i sprøyten kan reduseres:
a) å plassere sprøyten i isvann og holde enden avdekket.
b) klemme på stempelet og holde enden avdekket.
c) plassere sprøyten i varmt vann, og hold enden avdekket.
d) åpne spissen og skyve ut halvparten av luften ut av sprøyten.
e) å trekke stempelet og holde enden åpen.
Vedtak
Alternativ A. Trykket til en gass er direkte proporsjonalt med temperaturen i et isokorisk system, det vil si uten å endre volumet eller massen av gassen. Når det er en reduksjon i temperaturen, vil det også være et trykkfall.
Av Laysa Bernardes Marques de Araujo
Kjemilærer
Kilde: Brasilskolen - https://brasilescola.uol.com.br/quimica/transformacao-isocorica.htm