For at en kjemisk reaksjon skal skje, er det nødvendig å tilfredsstille fire grunnleggende betingelser, som er:
1. Reagenser må kontakte;
2. Det må være kjemisk affinitet mellom reagensene;
3. Kollisjoner mellom reagenspartikler må være effektive;
4. Aktiviseringsenergi må nås.
Se kort hvert tilfelle:
1.Kontakt mellom reagenser:
Denne tilstanden er åpenbar, for selv om reaktantene har mye affinitet med hverandre, som i tilfeller av syrer og baser, hvis de skilles fra hverandre, vil reaksjonen ikke forekomme. De må ta kontakt slik at partiklene deres kan kollidere, bryte reaktantenes bindinger og danne produktene.

2.Kjemisk affinitet:
Som vi har sett, er det nødvendig å bringe reagensene i kontakt, men ikke nok. Hvis vi for eksempel setter natrium i kontakt med vann, vil det oppstå en ekstremt voldsom reaksjon, men hvis vi setter gull, ser vi ingen forskjell. Dette er fordi forskjellige stoffer har forskjellige kjemiske affiniteter med hverandre, eller de har kanskje ikke noen affinitet i det hele tatt. Jo større kjemisk affinitet, desto raskere blir reaksjonen.
I de nevnte eksemplene har natrium stor affinitet med vann, så mye at for å ikke komme i kontakt med fuktigheten i luften, lagres metallisk natrium i parafin. Gull er inert, og det er derfor gullmonumenter varer så lenge, som sarkofager i Egypt.

3.Kollisjonsteori:
Selv i forbindelser som har kjemisk affinitet, for at reaksjonen skal fortsette, er det nødvendig at deres partikler, atomer eller molekyler kolliderer effektivt. Ikke alle partikler som kolliderer gjør dette effektivt, men støt som resulterer i å bryte reagensbindinger og dannelse av nye bindinger er de som oppstår i riktig retning og med energien nok.
Ikke stopp nå... Det er mer etter annonseringen;)
Nedenfor vises tilfellet med to ineffektive kollisjoner og en effektiv kollisjon som resulterer i at reaksjonen oppstår.
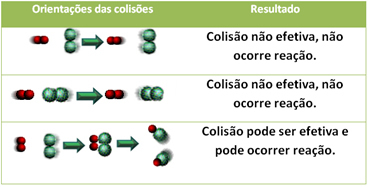
4.Aktiviseringsenergi og aktivert kompleks:
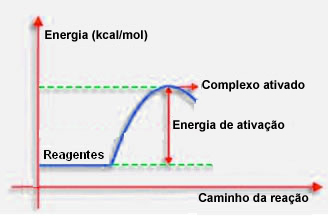
Som nevnt i forrige punkt, trenger effektiv kollisjon, i tillegg til gunstig veiledning, også tilstrekkelig energi. Den minste mengden energi som trengs for at hver reaksjon skal finne sted, kalles aktiveringsenergien.
Hvis reaktantene har en energi som er lik eller større enn aktiveringsenergien, under det velorienterte sjokket, et opprinnelig aktivert kompleks vil dannes, som er en mellomstruktur mellom reaktantene og Produkter. I det aktiverte komplekset dannes det svekkede reagensbindinger og nye produktbindinger.
Dermed fungerer aktiveringsenergien som en slags barriere for at reaksjonen skal skje, fordi jo større den er, jo vanskeligere vil det være for reaksjonen å skje. I noen tilfeller er det nødvendig å levere energi til reagensene. Matlagingsgass har for eksempel en affinitet til å samhandle med oksygen i luften, men vi trenger å levere energi når vi bringer kampen, ellers finner ikke reaksjonen sted. Men når den er startet, frigjør selve reaksjonen nok energi til å aktivere de andre molekylene og holde reaksjonen i gang.
Av Jennifer Fogaça
Uteksamen i kjemi
Vil du referere til denne teksten i et skole- eller akademisk arbeid? Se:
FOGAÇA, Jennifer Rocha Vargas. "Betingelser for forekomst av kjemiske reaksjoner"; Brasilskolen. Tilgjengelig i: https://brasilescola.uol.com.br/quimica/condicoes-para-ocorrencia-reacoes-quimicas.htm. Tilgang 27. juni 2021.


