Atom er navnet gitt til materieformeren (alt som opptar plass og har masse). Dette navnet ble foreslått av de greske filosofene Democritus og Leucippus. Kjemiske elementer, molekyler, stoffer og organiske eller uorganiske materialer dannes av atomer.
I sin konstitusjon har atomet partikler (protoner, nøytroner og elektroner), ikke den minste delen av saken. Fortsatt, visualiseringen din er ikke mulig. Det som er kjent om atomet er relatert til vitenskapelig bevist fysiske, kjemiske og matematiske aspekter.
Utviklingen av kunnskap om atomet har fått flere teknologier til å bli utviklet og forbedret.
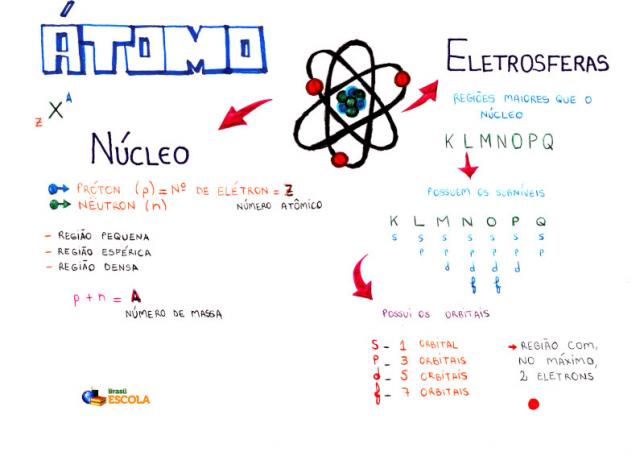
Grunnleggende sammensetning av et atom
Kjerne: tettere område av atomet og holder protoner og nøytroner;
Energinivåer: regioner som omgir kjernen og som huser undernivåer, orbitaler og elektroner. Det er syv energinivåer, som er representert med bokstavene K, L, M, N, O, P og Q;
Energinivåer: er regioner som huser orbitalene. De er til stede på alle nivåer og er representert med bokstaver (s, p, d f). Mengden avhenger av hvert nivå: K (har s undernivåer), L (har s og p undernivåer), M (har s, p og d undernivå), N (har undernivåer s, p, d og f), O (har undernivåer s, p, d og f), P (har undernivåer s, p og d) og Q (har undernivåer s og P);
Atomiske orbitaler: regioner som mest sannsynlig finner et elektron. Hvert delnivå har forskjellig antall orbitaler: s (en orbital), p (tre orbitaler), d (fem orbitaler) og f (syv orbitaler);
protoner: positive partikler (representert med p);
elektroner: negative partikler som også har bølgeatferd (representert ved e);
nøytroner: uladede partikler som reduserer frastøtingen mellom protoner i kjernen (representert av n).
Tankekart: Atom
* For å laste ned tankekartet i PDF, Klikk her!
representasjon av et atom
Den enkleste måten å representere et atom på er å bruke forkortelsen til det kjemiske elementet det danner. Forkortelsen Se representerer for eksempel alle atomene som danner det kjemiske elementet selen.
Forkortelsen som representerer atomet, kan fremdeles gi to viktige opplysninger: atomnummeret (representert med bokstaven Z og alltid på venstre side bunnen av atomets akronym) og massetallet (representert med bokstaven A, som kan plasseres på venstre eller høyre side øverst på akronymet til atom).
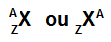
Forkortelse av et atom med massetall og atomnummer
atomnummer (Z): indikerer antall protoner som er til stede i atomkjernen og antall elektroner (e) som er tilstede i energinivået.
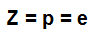
Formel som indikerer atomnummerets representativitet
Massetall (A): indikerer massen til stede i atomkjernen, som er resultatet av summen av antall protoner (p) og antall nøytroner (n).

Formel som indikerer representativiteten til massenummeret
Atomiske likheter
Atomer med det samme kjemiske elementet eller forskjellige kjemiske elementer kan sammenlignes når det gjelder antall protoner, elektroner, nøytroner og masse, og klassifiseres som følger:
a) Isotoper
Dette er atomer som har:
samme atomnummer;
samme antall protoner;
forskjellig massenummer;
forskjellig antall nøytroner;
Eksempel:
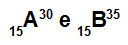
Atomer A og B er isotoper
Atomer A og B er isotoper fordi:
Atom A har 15 protoner, atomnummer lik 15, 15 elektroner, 15 nøytroner og massetall lik 30.
Atom B har 15 protoner, atomnummer lik 15, 15 elektroner, 20 nøytroner og massetall lik 35.
b) Isobarer
Dette er atomer som har:
forskjellige atomnumre;
forskjellige antall protoner;
forskjellige antall elektroner;
samme massetall;
forskjellige antall nøytroner.
Eksempel:
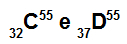
Atomer C og D er isobarer
Atomer C og D er isobare fordi:
Atom C har 32 protoner, atomnummer lik 32, 32 elektroner, 23 nøytroner og massetall lik 55.
Atom D har 37 protoner, atomnummer lik 37, 37 elektroner, 18 nøytroner og massetall lik 55.
c) Isotoner
Dette er atomer som har:
forskjellige atomnumre;
forskjellige antall protoner;
forskjellige antall elektroner;
forskjellige massetall;
samme antall nøytroner.
Eksempel:
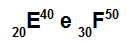
Atomer E og F er isotoper
Atomer E og F er isotoper fordi:
Atom E har 20 protoner, atomnummer lik 20, 20 elektroner, 20 nøytroner og massetall lik 40.
Atom F har 30 protoner, atomnummer lik 30, 30 elektroner, 20 nøytroner og massetall lik 50.
d) Isoelektronikk
Dette er atomer som har:
samme antall elektroner.
MERK: isoelektroniske atomer kan også ha samme massetall (isobarer), samme antall nøytroner (isotoner) eller samme antall protoner (isotoper).
Eksempel:
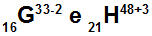
Atomer G og H er isoelektroniske
Atomer G og H er isoelektroniske fordi:
Atom G har 16 protoner, atomnummer lik 16, 18 elektroner (tegnet -2 indikerer at det har to flere elektroner enn antall protoner), 17 nøytroner og massetall lik 33.
Atom H har 21 protoner, atomnummer lik 21, 18 elektroner (+3-tegnet indikerer at det har tre færre elektroner enn antall protoner), 27 nøytroner og massetall lik 48.
Av meg. Diogo Lopes Dias
Kilde: Brasilskolen - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-atomo.htm

