DE vinkelgeometri er en av flere typer molekylær geometri, som fremdeles kan være lineær, pyramideformet, flat trigonal, tetraeder, etc. Vinkelgeometri kan bare finnes i molekyler som har følgende egenskaper:
Triatomics, det vil si at de bare har tre atomer;
Ha minst tre elektronskyer i det sentrale atomet.
Merk: elektronisk sky er alt kovalent binding (enkelt, dobbelt, trippel eller koordinat) mellom atomer og elektronpar av valenssjikt som ikke deltar i en samtale.
Se noen eksempler på molekyler som har vinkelgeometri:
Første eksempel: vann (H2O)

konvensjonell vannstruktur
I vannstrukturen har vi:
Tre atomer: to hydrogener og ett oksygen;
Oksygen er det sentrale atomet fordi det lager et større antall bindinger (to, da det tilhører VIA-familien);
To enkeltbindinger mellom oksygen og hydrogener. Dette er fordi hvert hydrogen bare kan lage en binding og oksygen to bindinger;
Fire ikke-bindende elektroner i oksygen, da den har seks elektroner i valensskallet og bare bruker to i bindingene.
Som i vannmolekylet er det derfor tre atomer og fire elektroniske skyer (to enkeltbindinger og to ikke-bindende elektronpar) i det sentrale atomet,
geometri er kantet.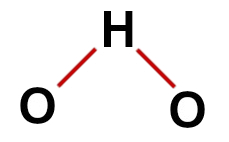
Riktig strukturformel av vann
Merk: Når molekylet presenterer disse mønstrene, er vinkelen dannet mellom atomene omtrent 109º 28'.
Ikke stopp nå... Det er mer etter annonseringen;)
Andre eksempel: Svoveldioksid (SO2)

Konvensjonell struktur av svoveldioksid
I strukturen av svoveldioksid har vi:
Tre atomer: to oksygener og et svovelatom;
Svovel er det sentrale atomet siden det er det minste elementet i molekylet, siden alle grunnstoffene trenger å lage samme antall bindinger (to);
En dobbeltbinding mellom svovel og en av oksygene. Det er fordi begge trenger to forbindelser;
En koordinat eller dativ kovalent binding, fordi svovelet var stabilt etter sammenkoblingen med det andre oksygenet, men det er fortsatt et oksygenatom som trenger to elektroner;
Fire ikke-bindende elektroner i oksygen. Det er fordi oksygen har seks elektroner i valensskallet og bare bruker to i bindingene.
Som i svoveldioksidmolekylet er det tre atomer og fire elektroniske skyer (to enkeltbindinger og to par ikke-bindende elektroner) i det sentrale atomet, geometri er kantet.
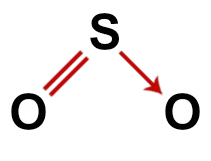
Riktig strukturformel av svoveldioksid
Merk: Når molekylet har disse mønstrene, er vinkelen dannet mellom atomene omtrent 120O.
Av meg. Diogo Lopes Dias
Vil du referere til denne teksten i et skole- eller akademisk arbeid? Se:
DAGER, Diogo Lopes. "Hva er vinkelgeometri?"; Brasilskolen. Tilgjengelig i: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-geometria-angular.htm. Tilgang 27. juni 2021.