Når man utfører nomenklaturen for organiske forbindelser, er en av de største vanskelighetene som kjemistudenter støter på, nomenklaturen for forgreninger og substituerende organiske radikaler. I denne teksten vil vi se hvilke som er hovedgruppene av grener og radikaler som vises i karbonkjeder, og hvordan man kan navngi dem uten feil.
Når hovedkjeden er valgt og nummerert, regnes alle gjenværende kjeder som grener. Navnet på disse grenene må komme foran navnet på hovedkjeden, i alfabetisk rekkefølge og med karbonnummeret som grenen går ut fra.
Navnene på disse grenene må imidlertid ta hensyn til to viktige opplysninger. La oss se på hver av dem:
1. Båndtypen mellom karbonene:
Når det gjelder mettede grener, det vil si som bare har enkeltbindinger mellom karbonene sine, vil navnet følge følgende regel:

Dette betyr at navnene deres er avledet fra den tilsvarende alkanen, og endrer enden ANO til IL eller ILA (derav det generiske navnet for alkyl- eller alkylgrupper). Se eksemplet:
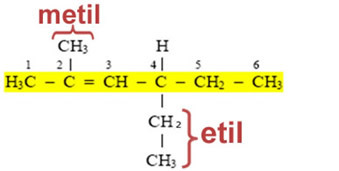
I tillegg til disse organiske gruppene som bare har enkle bindinger mellom karbon; det er andre som er avledet fra umettede forbindelser og aromatiske forbindelser. Navnene på rektorene er vist nedenfor:

2. Typer karbon der valensen som forbinder grenen med hovedkjeden er funnet:
På videregående er det også vanlig å studere grenene som er knyttet til hovedkjeden bare gjennom en enkel lenke, som kalles monovalent.
På dette punktet er det interessant å vite forskjellen mellom en organisk radikal og en substituent.
Når en organisk forbindelse lider a homolytisk splittelse, det vil si et brudd i bindingen mellom et karbonatom og et hydrogenatom i kjeden, der hvert atom tar ett elektron fra bindingen; vi sier at en radikal. Dermed er en organisk radikal en isolert gren, som ikke er knyttet til kjeden.
Ikke stopp nå... Det er mer etter annonseringen;)
Men radikaler er svært ustabile og reaktive kjemiske arter som lett kan ta plass til et annet atom (vanligvis hydrogen) i karbonkjeden. Når det skjer, blir det en erstatning.
vanligvis bruker prefikser i navnene på disse substituentene for bedre å presentere strukturen. De viktigste er listet opp nedenfor:
- Dette: dette prefikset brukes når den frie valensen er lokalisert på det primære karbonet i en forgrenet kjede. Det brukes vanligvis til å identifisere radikaler som har følgende generelle struktur:
H3Ç CH ─ (CH2)Nei─
|
CH3
Hvor n kan ta verdier på 0, 1, 2, 3, etc.
Eksempler:

- Sek- eller s-: dette prefikset brukes til å indikere fri valens på det sekundære karbonet. Eksempler:
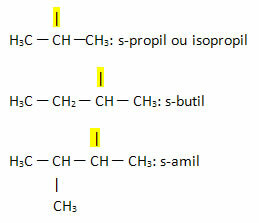
- Tredje- eller t-: dette prefikset brukes til å indikere at den frie valensen er lokalisert på tertiær karbon.
Eksempler:

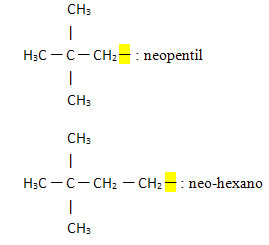
- Neo- eller n-: dette prefikset indikerer at den frie valensen er lokalisert på det primære karbonet og generelt indikerer tilstedeværelsen av følgende gruppe:
CH3
|
H3Ç ─C ─ (CH2)Nei─
|
CH3
Eksempler:
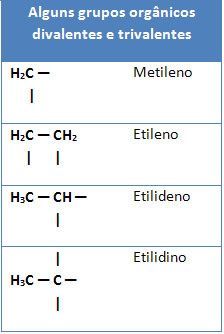
Nedenfor har vi også noen eksempler på organiske grupper divalent og trivalenter:
Av Jennifer Fogaça
Uteksamen i kjemi
Vil du referere til denne teksten i et skole- eller akademisk arbeid? Se:
FOGAÇA, Jennifer Rocha Vargas. "Nomenklatur av grenene"; Brasilskolen. Tilgjengelig i: https://brasilescola.uol.com.br/quimica/nomenclatura-ramificacoes.htm. Tilgang 27. juni 2021.
Alkananomenklatur, hydrokarbonfunksjon, karbonvalenser, International Union of Ren og anvendt kjemi, IUPAC, mettede alifatiske hydrokarboner, enkeltbindinger, forbindelser Organisk.