En isobar transformasjon skjer når gassen har et konstant trykk. For eksempel, hvis det gjøres i et åpent miljø, vil transformasjonen være isobar, ettersom trykket vil være atmosfæretrykk som ikke vil endres.
I dette tilfellet varierer temperatur og volum. To ledende forskere har studert hvordan denne variasjonen i isobariske transformasjoner oppstår. Den første som fortalte volum og temperatur på gasser var Jacques Charles (1746-1823), i 1787, og deretter, i år 1802, kvantifiserte Joseph Gay-Lussac (1778-1850) dette forholdet.
Dermed dukket det opp en lov som forklarer de isobare transformasjonene av gasser, som ble kjent som Charles / Gay-Lussac-loven. Det heter som følger:
"I et system med konstant trykk er volumet av en fast masse av en gass direkte proporsjonal med temperaturen."

Dette betyr at hvis vi dobler temperaturen, vil volumet av gassen også dobles. På den annen side, hvis vi senker temperaturen, vil også gassvolumet reduseres i samme andel.
Dette kan sees i et veldig enkelt eksperiment. Hvis vi plasserer en ballong i nakken på en flaske, blir en fast luftmasse fanget. Hvis vi dypper denne flasken i en bolle med isvann, vil ballongen tømme. Nå, hvis vi legger den i en bolle med varmt vann, fylles ballongen.
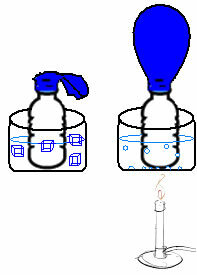
Dette skyldes at når temperaturen øker, øker den kinetiske energien til gassmolekylene, og hastigheten de beveger seg på øker også. Dermed utvides gassen, og øker volumet den opptar, og ballongen blåses opp. Det motsatte oppstår når vi senker temperaturen og legger den i kaldt vann.
Dette forholdet mellom temperatur og volum i isobariske transformasjoner er gitt av følgende forhold:
V = k
T
"k" er en konstant, som det fremgår av følgende graf:
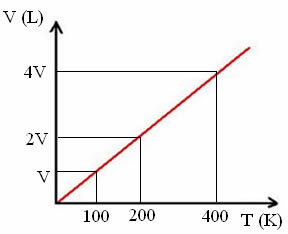
Merk at V / T-forholdet alltid gir en konstant:
_V_ =_2V_ = _4V_
100 200 400
Dermed kan vi etablere følgende forhold for isobariske transformasjoner:
Vførste = VEndelig
Tførste TEndelig
Dette betyr at når det er noen endring i gassens temperatur ved konstant trykk, kan vi finne volumet ved hjelp av dette matematiske uttrykket. Det motsatte er også sant, når vi vet volumet på gassen, finner vi ut hvilken temperatur den er ved. Se et eksempel:
"En gassformig masse opptar et volum på 800 cm3 ved -23 ° C, ved et gitt trykk. Hva registreres temperaturen når gassmassen, ved samme trykk, opptar et volum på 1,6 L? "
Vedtak:
Data:
Vførste = 800 cm3
Tførste = -23 ºC, og legger til 273 vi har 250 K (Kelvin)
VEndelig = 1,6 l
TEndelig = ?
* Først må vi la volumet være på samme enhet. Det er kjent at 1 dm3 tilsvarer 1 liter. som en 1 dm3 er det samme som 1000 cm3, ser det ut til at 1 liter = 1000 cm3:
1 L 1000 cm3
x 800 cm3
x = 0,8 l
* Nå erstatter vi formelverdiene og finner den endelige temperaturverdien:
Vførste = VEndelig
Tførste TEndelig
0,8_ = 1,6
250 TEndelig
0,8 TEndelig = 250. 1,6
TEndelig = 400
0,8
TEndelig = 500K
* Når vi går til Celsius-skalaen, har vi:
T (K) = T (° C) + 273
500 = T (° C) + 273
T (° C) = 500 - 273
T (° C) = 227 ° C
Av Jennifer Fogaça
Uteksamen i kjemi
Kilde: Brasilskolen - https://brasilescola.uol.com.br/quimica/transformacao-isobarica.htm
