Du metaller de er kjemiske elementer som har sin viktigste fysiske egenskap evnen til å miste elektroner og følgelig danne metalliske kationer. Av denne grunn kan de lage to typer kjemiske bindinger: ionbinding og metallbinding.
DE ionisk binding oppstår når et metall samhandler med et element av metallisk natur, som kan være en ametal eller hydrogen. I denne typen binding har vi tap av elektroner av metallene og gevinst av elektroner av ikke-metaller eller hydrogen.
allerede den metallbinding er etablert mellom atomene til et enkelt metallisk element. Denne typen binding forekommer bare mellom atomene til et enkelt metall og utelukkende fordi et metall ikke kan etablere en kjemisk binding med et annet metallisk element.
Generelle egenskaper ved metaller
Tørrstoffer ved romtemperatur, med unntak av kvikksølv;
De er strålende;
De har høye smeltepunkter og kokepunkter;
De er vanligvis sølvfargede, med unntak av gull, som er gyldent, og kobber, som er rødaktig;
Rene metaller dannes av klynger av atomer (av et enkelt kjemisk element) kalt krystallgitter.
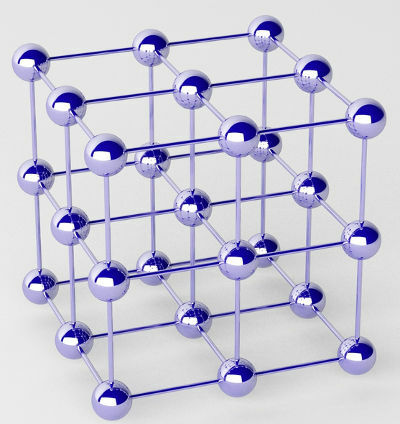
Representasjon av det krystallinske gitteret av et metall
Prinsipper for metallbinding
På metallbinding, de krystallinske gitterene som danner metallene er faktisk en ionisk klynge (bare sammensatt av kationer og elektroner). Elektronene som er tilstede i valenslaget til metallatomer, blir avlokalisert, det vil si at de forlater valenslaget og forårsaker atomet blir en kation (mangel på elektroner).
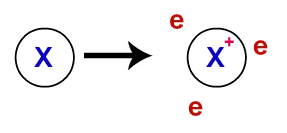
Representasjon av delokaliserte elektroner fra valensskallet
Etter å ha blitt avlokalisert begynner elektronene fra metallatomene å omgir kationene og danner et ekte “elektronhav”. Hver av elektronene som er tilstede i dette havet har evnen til å bevege seg fritt gjennom det krystallinske gitteret til metallet.

Representasjon av elektronhavsmodellen
MERK: Elektroner “fra havet” er ikke i stand til å forlate krystallgitteret og bevege seg gjennom det.
Egenskaper av metaller rettferdiggjort ved metallbinding
a) smidbarhet
Gjennom et metall er det mulig å produsere ark med forskjellige tykkelser og ark. Det er takket være denne egenskapen til metaller at vi kan bygge forskjellige gjenstander, for eksempel kniver, sverd, etc.

Sverdbladet er laget av metall
b) Konduktivitet
Metaller er generelt gode ledere av elektrisk strøm og varme. Når metall er i kontakt med en varmekilde eller en elektrisk strømkilde, er det i stand til å lede dem.

En aluminiumspanne i ovnens flamme blir helt varm på grunn av ledningsevne.
c) Ductibility
Gjennom et metall kan vi produsere ledninger. Bruken av et metall i form av ledninger letter bruken, spesielt i forhold til elektrisk ledningsevne.

Et metall, som kobber, kan brukes til å produsere ledninger.
Av meg. Diogo Lopes Dias
Kilde: Brasilskolen - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-ligacao-metalica.htm
