vi har en blanding av løsninger med forskjellige oppløste stoffer uten kjemisk reaksjon når to eller flere blandinger som har stoffer med samme ion til felles (enten samme kation eller samme anion). Som i eksemplet nedenfor:
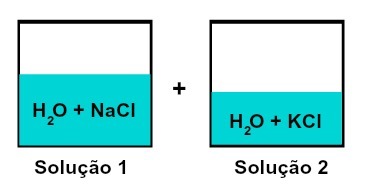
Blanding av løsninger som har forskjellige oppløste stoffer
Løsning 1 er vann og natriumklorid (NaCl), mens løsning 2 har vann og kaliumklorid (KCl). Når vi blandes sammen har vi en blanding av forskjellige løsningsmidler uten kjemisk reaksjon, fordi begge saltene som brukes har kloridanionet (Cl-).
1- Kjennetegn på blandinger av forskjellige oppløste løsninger uten kjemisk reaksjon
Når det utføres en blanding av løsninger som har forskjellige oppløste stoffer uten kjemisk reaksjon, kontrolleres alltid egenskapene nedenfor:
Massen til hver av de oppløste stoffene endres ikke (hvis vi i løsning 1 har 10 g oppløst stoff og i 2, 30 g, for eksempel, etter blanding vil vi ha den samme massen av hver oppløsningsmiddel),
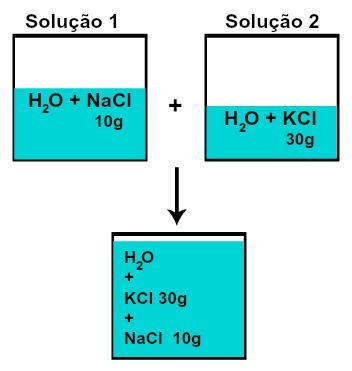
Masse av hver av de oppløste stoffene etter blandingsløsninger uten kjemisk reaksjon
DE mengde materie (n) av hver av de oppløste stoffene endres ikke (hvis vi i løsning 1 har 5 mol oppløst stoff, og i 2, 4 mol, for eksempel, etter blanding vil vi ha samme mengde materie av hver),
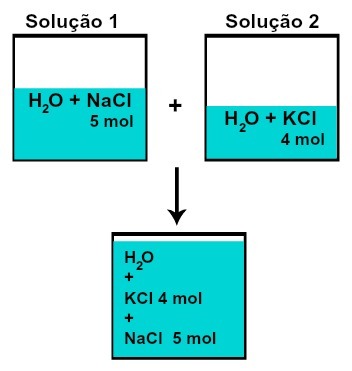
Antall mol av hver av de oppløste stoffene etter blandingsløsninger uten kjemisk reaksjon
Volumet av den endelige løsningen, VF, er resultatet av summen av volumene til hver av de blandede løsningene (hvis vi i løsning 1 har 200 ml og i løsning 2, 300 ml, for eksempel, etter blanding vil vi ha 500 ml volum),
VF = V1 + V2
2- Formler brukt i beregninger av blandingsløsninger av forskjellige oppløste stoffer uten kjemisk reaksjon.
Som i denne typen blandinger har vi bare en økning i mengden løsemiddel i forhold til hver av oppløste stoffer, må vi beregne den endelige konsentrasjonen av hver av de oppløste stoffene ved hjelp av følgende uttrykkene:
a) Til felles konsentrasjon (Ç)
For løsning 1: multiplikasjonen av konsentrasjonen av løsning 1 med volumet er lik sluttkonsentrasjonen multiplisert med volumet
Ç1.V1 = CF.VF
For løsning 2: multiplikasjonen av konsentrasjonen av løsning 2 med volumet er lik sluttkonsentrasjonen multiplisert med volumet
Ç2.V2 = CF.VF
b) Til konsentrasjon i mengde materie eller molaritet (M)
For løsning 1:
M1.V1 = MF.VF
For løsning 2:
M2.V2 = MF.VF
c) Konsentrasjon i mengde materie av hvert ion som er tilstede i løsningen
Hvis vi må bestemme konsentrasjonen av en eller alle ionene i den endelige løsningen, må vi:
1º: Husk at ionekonsentrasjonen er gitt ved multiplikasjon av konsentrasjonen (M), av det oppløste stoffet den kommer fra, ved sin indeks i stoffformelen. Så for ionet Y, i substans 1, XY3vil konsentrasjonen være:
[Y]1 = 3. M
Når det gjelder løsemiddel 2, ZY, vil konsentrasjonen av Y bli gitt av:
[Y]2 = 1. M
2º: Hvis vi for eksempel har mer enn en oppløsningsmiddel som frigjør det samme ionet, oppløses XY3 og ZY, som har samme ion Y, blir konsentrasjonen av dette ionet i den endelige løsningen gitt av summen av konsentrasjonene for hver løsemiddel:
[Y]F = [Y]1 + [Y]2
3- Eksempler på beregninger som involverer blandingsløsninger av forskjellige oppløste stoffer uten kjemisk reaksjon
Eksempel 1: (PUC SP) I et begerglass ble 200 ml av en vandig løsning av kalsiumklorid (CaCl) blandet2) med 0,5 mol konsentrasjon. L–1 og 300 ml av en 0,8 mol løsning. L–1 av natriumklorid (NaCl). Den oppnådde løsningen har en kloridanionkonsentrasjon på ca.
a) 0,34 mol. L–1
b) 0,65 mol. L–1
c) 0,68 mol. L–1
d) 0,88 mol. L–1
e) 1,3 mol. L–1
Dataene som ble gitt av øvelsen var:
Løsning 1:
Volum (V1): 200 ml
Molekonsentrasjon (M1): 0,5 mol. L–1
Løsning 2:
Volum (V2): 300 ml
Molekonsentrasjon (M2): 0,8 mol. L–1
For å bestemme konsentrasjonen av kloridanioner (Cl-), må vi følge disse trinnene:
Trinn 1: beregne volumet på den endelige løsningen
VF = V1 + V2
VF = 200 + 300
VF = 500 ml
Steg 2: Beregn molar konsentrasjonen av den endelige løsningen med hensyn til CaCl oppløst stoff2, ved å bruke uttrykket nedenfor:
M1.V1 = MF.VF
0,5,200 = MF.500
100 = MF.500
100 = MF
500
MF = 0,2 mol. L–1
Trinn 3: Beregn molar konsentrasjonen av klorid [Cl-]1, i den endelige løsningen, fra CaCl-løsemidlet2, ved å bruke uttrykket nedenfor:
MERK: I formelen har vi multipliseringen av molaritet med 2 fordi vi har indeks 2 i Cl, i den oppløste formelen CaCl2.
[Cl-]1 = 2.MF
[Cl-]1 = 2. 0,2
[Cl-]1 = 0,4 mol. L–1
Trinn 4: Beregn den molare konsentrasjonen av den endelige løsningen i forhold til NaCl-løsemidlet, ved å bruke uttrykket nedenfor:
M2.V2 = MF.VF
0,8,300 = MF.500
240 = MF.500
240 = MF
500
MF = 0,48 mol. L–1
Trinn 5: Beregn molar konsentrasjonen av klorid, [Cl-]2, i den endelige løsningen, fra NaCl-løsemidlet, ved å bruke uttrykket nedenfor:
MERK: I formelen har vi multipliseringen av molaritet med 1 fordi vi har indeks 1 i Cl, i formelen for det oppløste NaCl.
[Cl-]2 = 1.MF
[Cl-]2 = 1. 0,48
[Cl-]2 = 0,48 mol. L–1
Trinn 6: Beregn den totale mengden kloridioner i den endelige løsningen
For å gjøre dette er det bare å legge til molare konsentrasjoner av klorider for hver av de oppløste stoffene i trinn 3 og 5:
[Cl-]F = [Cl-]1+ [Cl-]2
[Cl-]F = 0,4 + 0,48
[Cl-]F = 0,88 mol. L–1
Eksempel 2: Til en løsning av 500 ml 6 mol / L KOH ble det tilsatt 300 ml K-løsning.2KUN3 3 mol / l. Hva er konsentrasjonen av hver av de oppløste stoffene i den resulterende blandingen
a) 3,75 og 3,0 mol / l
b) 3,75 og 1,215 mol / l
c) 4,5 og 1,125 mol / l
d) 3,75 og 1,125 mol / l
e) 4,5 og 1,215 mol / l
Dataene som ble gitt av øvelsen var:
Løsning 1:
Volum (V1): 500 ml
Molekonsentrasjon (M1): 6 mol. L–1
Løsning 2:
Volum (V2): 300 ml
Molekonsentrasjon (M2): 3 mol. L–1
For å bestemme konsentrasjonen av kloridanioner (Cl-), må vi følge disse trinnene:
Trinn 1: beregne volumet på den endelige løsningen
VF = V1 + V2
VF = 500 + 300
VF = 800 ml
Steg 2: Beregn molar konsentrasjonen av den endelige løsningen i forhold til KOH-løsemidlet, ved å bruke uttrykket nedenfor:
M1.V1 = MF.VF
6500 = MF.800
3000 = MF.800
3000 = MF
800
MF = 3,75 mol. L–1
Trinn 3: Beregn molar konsentrasjonen av den endelige løsningen i forhold til oppløst K2KUN3, ved å bruke uttrykket nedenfor:
M2.V2 = MF.VF
3.300 = MF.800
900 = MF.800
900 = MF
800
MF = 1,125 mol. L–1
Av meg. Diogo Lopes Dias
Kilde: Brasilskolen - https://brasilescola.uol.com.br/quimica/mistura-solucoes-com-solutos-diferentes-sem-reacao-quimica.htm

