diffusjon og effusjon er to lover foreslått av den skotske kjemikeren Thomas Graham, på 1800-tallet, basert på hans studier om gassblandinger og oppførselen til gasser når du går gjennom veggene i en container.
Blant observasjonene gjort av Thomas Graham om gassers oppførsel i forhold til diffusjon og effusjon, kan vi fremheve følgende:
En gass har alltid en tendens til å passere gjennom små hull som er tilstede i faststoffmateriale;
Jo større molekylmasse jo gass, jo større er vanskeligheten med å passere gjennom hullene i fast stoff;
Jo lavere tettheten til gassen er, desto større bevegelseshastighet;
Jo høyere temperaturen en gass utsettes for, jo større hastighet spres den i omgivelsene eller passerer gjennom en åpning;
- En gass forblir aldri statisk et bestemt sted.
Spredning
Spredning det er et fysisk fenomen som består i en gasss evne til å diffundere (det vil si å spre seg) gjennom rommet i et område eller inne i en container. Av denne grunn kan vi si at en gass i et rom aldri er begrenset til et sted.

Representasjon av forekomsten av en sending
I tillegg kan vi definere spredning fremdeles som kapasiteten som en gass har til å blande seg med en annen når den plasseres i samme beholder og danner en homogen gassblanding.
Et eksempel er når gasser kommer ut av eksos fra kjøretøyet. Så giftige de er, forårsaker de ikke kortsiktig skade på mennesker, ettersom de sprer seg gjennom den atmosfæriske luften og reduserer følgelig konsentrasjonen.
Effusjon
Effusjon det er et fysisk fenomen som består i passering av en gass gjennom hull som eksisterer i veggene til en bestemt beholder, det vil si at den består i utgangen av en gass fra et miljø til et annet.

Representasjon av forekomsten av et utgytelse
Et eksempel er når ballongene blåses opp for en fest, og neste dag tømmes de alle, alt på grunn av at luften slipper ut gjennom hullene i ballongene.
Beregninger relatert til diffusjon og effusjon
Vi kan beregne, i henhold til ligninger foreslått av Graham, hastigheten som en gass utfører diffusjon eller effusjon. Ifølge Graham er diffusjons- og effusjonshastighetene til to gasser blandet i en beholder alltid omvendt proporsjonal med kvadratet av deres relative tetthet eller deres molare masse.
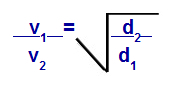
Grahams lov med hensyn til tetthet
v1 = hastighet (effusjon eller diffusjon) av gass 1 i blandingen;
v2 = hastighet (effusjon eller diffusjon) av gassen 2 i blandingen;
d1 = tetthet av gass 1 av blandingen;
d2 = tetthet av gass 2 i blandingen;
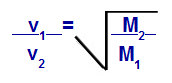
Grahams lov angående molarmesse
v1 = hastighet (effusjon eller diffusjon) av gass 1 i blandingen;
v2 = hastighet (effusjon eller diffusjon) av gassen 2 i blandingen;
M1 = molær masse av gass 1 av blandingen;
M2 = molær masse gass 2 i blandingen.
Av meg. Diogo Lopes Dias
Kilde: Brasilskolen - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-difusao-efusao.htm
