Utgangspunkt er uorganisk stoff som ifølge den svenske kjemikeren Svante Arrhenius, når den plasseres i vann, lider fenomenet ionisk dissosiasjon, der det er utgivelsen av ioner: kation (Y+) og hydroksidanion (OH-).

Generell formel for en Arrhenius-base
Y-gruppen av a utgangspunkt det kan være hvilket som helst metall eller annet fra ammoniumgruppen (NH4+), som frigjøres i vann som kationer under dissosiasjon, som vi kan se i ligningen som representerer prosessen:
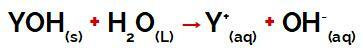
Ligning som representerer dissosiasjonen av en base
Se nedenfor noen veldig viktig informasjon om klassifisering og nomenklatur for baser.
1) Klassifisering angående løselighet av baser(evnen til å å oppløse i vannet)
Baser løselig: har alkalimetall eller ammonium i blandingen;
Baser lite løselig: har jordalkalimetall i komposisjon. Eksempel: magnesiumhydroksid, mye brukt som et antacida og avføringsmiddel;
baser praktisk talt uoppløselig: har noe annet metall i komposisjonen. Eksempel: aluminiumhydroksid, mye brukt som et syrenøytraliserende middel.
2) Klassifisering angående grasrotstyrke(evnen til å dissosiere i vannet)
Baser sterk: ha alkali- eller jordalkalimetaller, med unntak av magnesium, i sammensetningen;
Baser svak: har noe annet metall i komposisjonen.
3) Basenomenklatur
For å navngi en base, følg bare navngivningsregelen nedenfor:
Hydroksid + navn på metall eller ammonium
Eksempel: Ca (OH)2 → kalsiumhydroksid
Hvis basen har et kjemisk element som ikke tilhører IA-, IIA- eller IIIA-familiene (og det er ikke sølv eller sink), må vi oppgi foran elementets navn, i romertall, antall hydroksyler:
Eksempel: Ti (OH)4 → titanhydroksid IV
Av meg. Diogo Lopes
Kilde: Brasilskolen - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-base.htm