DE løselighet eller løselighetskoeffisient, det er en fysisk egenskap av materie som alltid er praktisk bestemt i laboratoriet. Det er relatert til kapasiteten som et materiale, kalt løsemiddel, gaver som skal oppløses av en annen, den løsemiddel.
Når det gjelder løselighet, kan oppløste stoffer klassifiseres som følger:
Løselige stoffer: de som oppløses i løsningsmidlet. Natriumklorid (oppløst stoff) er for eksempel løselig i vann (løsningsmiddel);
Litt løselig: de som har problemer med å oppløse i løsningsmidlet. Dette er tilfellet med kalsiumhydroksid [Ca (OH)2] (oppløst stoff) i vann;
Uoppløselige: de oppløses ikke i løsningsmidlet. Sand (oppløst stoff) er for eksempel uoppløselig i vann.
DE løselighet er veldig assosiert med utarbeidelsen av løsninger (homogene blandinger), siden, for å oppnå en løsning, er det viktig at den oppløste løsningen er løselig i løsningsmidlet.
Faktorer som påvirker løseligheten
Selv når løsningsmidlet er løselig i løsningsmidlet, er det noen faktorer som kan påvirke løsemidlets oppløsningsevne. Er de:
a) Forholdet mellom mengden løsemiddel og løsemiddel
Løsningsmidlet har alltid en grense for oppløst stoff det kan oppløses. Hvis vi øker mengden løsemiddel mens vi opprettholder mengden løsemiddel, har løsningsmidlet en tendens til å oppløse alle løsemidlene som brukes.
B) Temperatur
Temperatur er den eneste fysiske faktoren som er i stand til å modifisere et løsningsmiddels løselighet i forhold til en gitt løsemiddel. Denne modifikasjonen avhenger av løsemidlets natur, som vi vil se nedenfor:
endotermisk løsemiddel: er den som vi klarer å oppløse en større masse, så lenge løsningsmidlet har en temperatur høyere enn romtemperatur. Jo varmere løsningsmidlet er, desto mer oppløses det.
Eksempel: Det er mulig å oppløse en større mengde malt kaffe når vannet er varmt.
Eksoterm løsemiddel: er den som vi klarer å oppløse en større masse, så lenge løsningsmidlet har en temperatur lavere enn romtemperatur. Jo kaldere løsningsmidlet er, desto mer oppløses det.
Eksempel: Det er mulig å oppløse en større mengde karbondioksid når brusen er kald.
Måter å bestemme løselighet på
Siden løseligheten er en egenskap bestemt på en eksperimentell måte, har materialene generelt allerede fått sine løseligheter evaluert i de mest forskjellige løsningsmidlene. Dermed kan vi få tilgang til oppløseligheten til et oppløst stoff i et bestemt løsemiddel som følger:
a) Analyse av en tabell
Ofte kan studenten komme over løselighet fra tolkningen av et bord. Se følgende eksempel:
Eksempel: (UEPG - tilpasset) Tabellen nedenfor viser løseligheten av Li-salt2CO3 i 100 gram vann.

Tabellen viser masseverdiene i gram Li2CO3 som kan oppløses i 100 gram vann, fra 0 OC til 50 OÇ. Vi kan se at jo varmere vannet, jo mindre Li2CO3 oppløses. Derfor er Li2CO3 det er en eksoterm oppløsningsmiddel (den vil oppløses mer hvis vannet er kaldt).
b) Analyse av en graf
Løselighet kan vurderes ved å tolke en graf. For å gjøre dette, bare bestemme temperaturen, vri den til kurven og vri deretter kurven til y-aksen, som er massen i gram oppløst stoff som vil oppløses.
Eksempel: (UFTM - tilpasset) Grafen viser løselighetskurven til et AX-salt2.
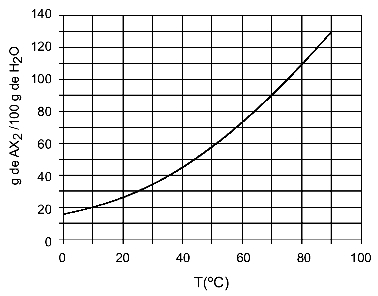
Grafen sier at på y-aksen er mengden vann (løsemiddel) 100 gram. For løsemiddel AX2, vil vi bestemme mengden vann ved følgende temperaturer:
30OÇ: Når vi slår på temperaturen 30OC til kurven og deretter kurven til y-aksen, vi har at 100 gram vann kan oppløse omtrent 35 gram oppløst AX ved denne temperaturen2.
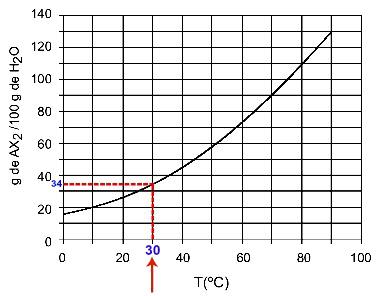
Bestemmelse av AX-løselighet2 klokka 30OÇ
40OÇ: Når vi slår på temperaturen 40OC til kurven og deretter kurven til y-aksen, vi har at ved denne temperaturen kan 100 gram vann oppløse omtrent 45 gram oppløst AX2.
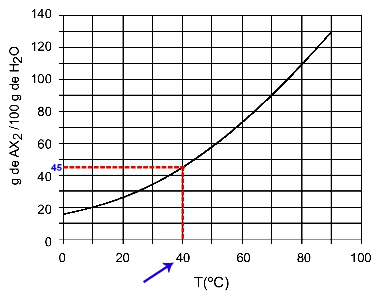
Bestemmelse av AX-løselighet2 på 40OÇ
Ettersom den oppløste mengden oppløst stoff er større for hver økning i temperatur, har vi at AX2 det er en endotermisk løsemiddel.
c) tekstfortolkning
Se følgende eksempel:
Eksempel: (PUC-MG) Visse stoffer er i stand til å danne homogene blandinger med andre stoffer. Stoffet som er i den største mengden kalles et løsningsmiddel, og det som er i den minste mengden kalles en løsemiddel. Natriumklorid (NaCl) danner en homogen løsning med vann, der det er mulig å oppløse, ved 20 ° C, 36 g NaCl i 100 g vann.
Teksten sier at hvis vi har 100 gram vann (løsemiddel), ved en temperatur på 20 OC, er det mulig å oppløse opptil 36 gram NaCl.
Av meg. Diogo Lopes Dias
Kilde: Brasilskolen - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-solubilidade.htm