Reversible reaksjoner starter vanligvis med en viss mengde reagenser. Når den direkte reaksjonen starter, forbrukes disse reagensene over tid for dannelsen av produktene, reduseres følgelig konsentrasjonen av reagensene mens konsentrasjonen av produktene øker. Deretter starter den omvendte reaksjonen, og produserer også reaktantene, til utviklingshastigheten (hastigheten) for de direkte og omvendte reaksjonene forblir den samme og når den såkalte kjemisk balanse.
I likevekt er det likevektskonstanten Kc, som i utgangspunktet uttrykkes av:
|
Kc = [Produkter]koeffisient i balansert kjemisk ligning [reagenser]koeffisient i balansert kjemisk ligning |
Det vil si med tanke på følgende generiske likevektsreaksjon:
a A + b B ↔ c C + d D
Siden små bokstaver er koeffisientene, og de store bokstavene er stoffene, vil likevektskonstanten for denne reaksjonen være:
Kc = [Ç]ç. [D]d
[DE]De. [B]B
Flere detaljer om dette kan sees i teksten Kc og Kp likevektskonstanter. Denne teksten viser oss også noe viktig: at Kc-verdier kan vise oss om konsentrasjonen av reagensene og produktene er like, eller hvis den ene er større enn den andre, og som en konsekvens, hvis den kjemiske balansen forskyves i en eller annen retning av reaksjon.
Så vi må bestemme verdien av Kc. For å gjøre dette, husk at disse beregningene er eksperimentelle, så la oss se på noen eksempler på reaksjoner og dataene som er hentet fra dem.
Noe som er veldig nyttig for å utføre disse beregningene, er å skrive en tabell som ligner den som er vist nedenfor og følge trinnene nevnt i den:

Tabell for å organisere dataene som brukes til å beregne likevektskonstanten
La oss nå øve:
Eksempel 1: I en lukket beholder, med en kapasitet på 2 liter, ved en temperatur på 100 ° C, er det 20 mol N2O4. Følgende reversible reaksjon begynner å skje: N2O4 ↔ NEI2. Etter en stund ble det funnet at reaksjonen nådde kjemisk likevekt og at 8 mol NO2 hadde dannet. Hva er verdien av likevektskonstanten Kc ved en temperatur på 100 ° C?
Vedtak:
La oss bruke tabellen:

Tabell brukt til å løse likevektskonstantberegningseksempel
Merk at i linjen hvor mengdene som reagerer og dannes ble skrevet, vet vi at 4 mol N ble brukt2O4fordi forholdet er 1: 2, og at 8 mol NO ble dannet2.
Nå er det bare å erstatte verdiene som er funnet i uttrykket for likevektskonstanten Kc i denne reaksjonen:
Kc = [PÅ2]2
[N2O4]
Kc = (4 mol / l) 2
(8 mol / l)
Kc = 2 mol / l
Verdien av Kc er dimensjonsløs, den har ingen enhet relatert til noen størrelse.
La oss nå se på et eksempel som også inneholder produkter fra begynnelsen:
Eksempel 2: I en lukket beholder, med en kapasitet på 5 liter, ved temperatur T, er det 2 mol hydrogengass, 3 mol jodgass og 4 mol hydrogenjodid. Reaksjonen går inn i kjemisk likevekt, ved temperatur T, og det viser seg at det er 1 mol hydrogengass i karet. Hva er grafen som representerer denne likevekten, og hva er verdien av likevektskonstanten Kc ved temperaturen T?
Vedtak:
Bruke tabell:
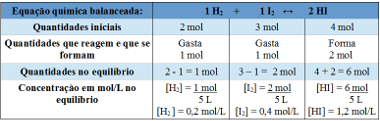
Tabell som brukes til å bestemme likevektskonstanten
Grafen som viser variasjonene i mol / L-konsentrasjoner av reagenser og produkter til de når likevekt, kan gis ved:

Kjemisk likevektsgraf som viser endringer i konsentrasjoner av reagenser og produkter
Nå oppdager vi verdien av likevektskonstanten:
Kc = __ [HI]2__
[H2 ]. [JEG2]
Kc = (1,2)2
0,2. 0,4
Kc = 18
Av Jennifer Fogaça
Uteksamen i kjemi
Kilde: Brasilskolen - https://brasilescola.uol.com.br/quimica/calculo-constante-equilibrio-kc.htm


