Når vi lager mat hjemme, bruker vi forbrenning av kokegass. En av tingene vi kan se i flammen som følge av forbrenningen av denne gassen er at fargen normalt er veldig lyseblå. Imidlertid er flammen gul i de fleste forbrenningsreaksjoner, for eksempel å brenne et lys.

Da oppstår spørsmålet:
"Hvis hver brann er et resultat av en forbrenningsreaksjon, hvorfor har noen flammer forskjellige farger?"
For å forstå hvordan dette skjer, må vi forstå hva en forbrenningsreaksjon er, og hvilke stoffer som er tilstede i hver av de nevnte reaksjonene.
En forbrenningsreaksjon oppstår når et drivstoff (oksiderbart materiale) forbrukes av et oksidasjonsmiddel (et gassformig materiale som inneholder oksygen) for å generere termisk energi (varme).
Et annet viktig poeng vi trenger å vite om forbrenningsreaksjoner er at de kan finne sted i en fullstendig eller ufullstendig. Hvis det er nok oksygen til å konsumere drivstoffet, vil reaksjonen være fullført og produsere karbondioksid (CO2) og vann (H2O). Ellers vil forbrenningen være delvis, ufullstendig og generere karbonmonoksid (CO) og vann; eller karbon (C) og vann.
I begge tilfeller analyserer vi, oksidasjonsmidlet er oksygenet som er tilstede i luften. Imidlertid er drivstoff forskjellige. Matlagingsgass er faktisk flytende petroleumsgass (LPG), som er en blanding av hydrokarboner (alkaner), hvor hoveddrivstoffet er butan (C4H10). Dermed består kokegass av alkanmolekyler som bare har tre eller fire karbonatomer, det er derfor lite oksygen er nødvendig for at forbrenningen skal finne sted helt. Denne reaksjonen kan uttrykkes som følger:
1C4H10 (g) + 13/2 O2 (g) → 4 CO2 (g) + 5 timer2O(g), ∆H <0
Når det gjelder stearinlys, er parafinen drivstoffet for reaksjonen, og det består av en blanding av alkaner med karbonatomer som fra 20 til 36. Derved, det tar mye mer oksygen for at denne reaksjonen skal finne sted fullt ut. Se et eksempel:
1C24H50 (er) + 70/2 O2 (g) → 25 CO2 (g) + 25 H2O(g), ∆H <0
I luften er det ikke nok oksygen til å utføre denne komplette forbrenningen, så det foregår ufullstendig, som vist nedenfor:
1C24H50 (er) +49/2 O2 (g) → 24 CO(g) + 25 H2O(g), ∆H <0
1C24H50 (er) +25/2 O2 (g) → 24C(s) + 25 H2O(g), ∆H <0
Ufullstendige reaksjoner produserer mindre energi enn fullstendig forbrenning. Dette forklarer forskjellen mellom fargene på flammene, da den gule flammen, karakteristisk for ufullstendig forbrenning, har lavere energi. Den blå flammen er karakteristisk for en fullstendig forbrenning, med større energi.
Dette forklarer også dannelsen av sot av lysflammen (bildet nedenfor), som er karbon som anses å være et produkt av ufullstendig forbrenning.
Men hvorfor, i Bunsen-brenneren, er det mulig å få gule og blå flammer når drivstoffet ikke skifter?
Når det gjelder Bunsen-brenneren, oppnås dette ved å regulere inntaket av gass og luft. Hvis vinduet er lukket og forårsaker at det kommer inn en liten mengde luft, vil den oppnådde flammen være gul, fordi den vil ha lite oksygen for å utføre full forbrenning. Hvis reguleringen av gass-luftblandingen er tilstrekkelig, får vi en blå flamme.
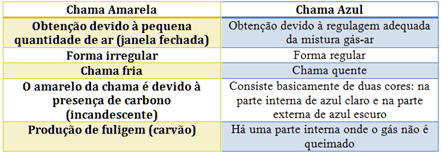
Se egenskapene til hver i tabellen nedenfor:
Av Jennifer Fogaça
Uteksamen i kjemi
Kilde: Brasilskolen - https://brasilescola.uol.com.br/quimica/combustao-chamas-cores-diferentes.htm
