Lær å anvende termodynamikkens første lov i ulike situasjoner, løs øvelser og test kunnskapene dine med løste og forklarte øvelser.
Spørsmål 1
Termodynamikkens første lov sier at:
a) Energi kan ikke skapes eller ødelegges, men den kan omdannes fra en form til en annen.
b) Energi er alltid bevart, men den kan ikke omdannes fra en form til en annen.
c) Energi kan skapes eller ødelegges, men den kan ikke omdannes fra en form til en annen.
d) Energi kan ikke bevares, men den kan omdannes fra en form til en annen.
Termodynamikkens første lov er prinsippet om bevaring av energi, så i et system lukket, forblir energimengden konstant og kan bare transformeres fra en form til en annen. annen.
spørsmål 2
Anta et lukket system som mottar 100 J varme mens du utfører 50 J arbeid. Hva er endringen i systemets indre energi?
a) -50 J
b) 0 J
c) 50J
d) 100J
e) 150J
Sjekker skiltene:
Mottatt varme er positiv Q > 0.
Arbeidet som er utført er positivt W > 0.
I henhold til den første loven har vi:
spørsmål 3
Et ideelt gasssystem utveksler 500 joule varme med det ytre miljøet. Forutsatt at denne prosessen er en isometrisk avkjøling, bestemmer du henholdsvis arbeidet og den indre energien.
a) 500 J og 0 J
b) - 500 og 0 J
c) 0 J og 500 J
d) 0 J og - 500 J
e) -500 J og 500 J
Siden prosessen er isometrisk, er det ingen endring i volum, så arbeidet er null.
I følge termodynamikkens første lov:
Siden det er en kjøling, mister systemet varme, derfor:
spørsmål 4
8 mol av en ideell gass i et stempel-sylindersystem komprimeres ved å utføre 1000 J arbeid. I løpet av prosessen går 400 J varme tapt til det ytre miljøet. Dens indre energi og endringen i temperaturen er henholdsvis lik
Gitt: R = 8,31 J/mol. K
a) - 1400 J og omtrentlig variasjon på 6 K
b) 600 J og omtrentlig variasjon på 6 K
c) 600 J og omtrentlig variasjon på 14 K
d) - 1400 J og omtrentlig variasjon på 14 K
indre energi
Når systemet mottar arbeid, er fortegn negativt, så vel som varmen, som i denne prosessen går tapt.
Termodynamikkens første lov er:
Ved å erstatte verdiene får vi:
R = 8,31 J/mol K
Temperatur
I henhold til Joules lov har vi:
spørsmål 5
En perfekt gass gjennomgår kompresjon og utfører 500 J arbeid. På slutten av denne transformasjonen endret den indre energien til systemet seg 200 J mindre enn ved begynnelsen. Mengden varme som ble utvekslet av gassen var
a) - 700 J
b) - 300 J
c) 300J
d) 0J
e) 700J
Siden arbeidet ble mottatt, det vil si motstandsdyktig arbeid, er tegnet negativt.
Bytter verdiene inn i ligningen til termodynamikkens første lov:
spørsmål 6
(CEDERJ 2021) I et stadium av syklusen utført av en ideell gass i et klimaanlegg, økes gasstrykket slik at volumet holdes konstant. På dette stadiet av syklusen er arbeidet W utført av gassen, mengden varme Q absorbert av den og endringen ΔT i dens temperatur, henholdsvis:
a) W < 0, Q < 0 og ΔT < 0
b) W = 0, Q > 0 og ΔT > 0
c) W = 0, Q = 0 og ΔT = 0
d) W > 0, Q > 0 og ΔT > 0
Data:
Trykk P øker;
Volumet forblir konstant;
Arbeid
Siden volumet er konstant, er arbeidet W lik null.
Termodynamikkens første lov går slik:
Siden varme er positiv, vil også endringen i indre energi være positiv.
Varme
Siden varme absorberes, er den positiv.
Temperatur
Etter gassloven:
Hvor,
n er antall mol
R er den universelle gasskonstanten
Dermed avhenger temperaturen bare av trykket, siden volumet er konstant, og er positivt.
spørsmål 7
(UNICENTRO 2018) I følge den første loven om termodynamikk er endringen i den indre energien til et system, ΔU, gitt av forskjellen mellom varmen som utveksles med det ytre miljøet, Q, og arbeidet, W, utført i prosessen termodynamisk. Tatt i betraktning denne informasjonen, hvis en monatomisk gass ekspanderer slik at den alltid forblir ved samme temperatur, kan denne transformasjonen representeres av ligningen
a) ΔU + W = 0
b) ΔU − W =0
c) Q − W = 0
d) Q + ΔU = 0
Isoterm prosess skjer uten temperaturendringer.
Energi er relatert til temperatur ved:
Hvor n er antall mol og R er den universelle gasskonstanten. Siden n og R er konstante, er det kun temperaturvariasjon, og
Termodynamikkens første lov går slik:
spørsmål 8
(URCA 2016) I henhold til termodynamikkens første lov hvis gassen frigjør under en isoterm prosess som gjennomgås av en ideell gass med fast masse en varmemengde hvis størrelse er 50 cal, så er endringen i indre energi og arbeidet utført av gassen i denne prosessen, henholdsvis:
a) 0 og 50 cal.
b) 50 cal og 0.
c) 0 og 0.
d) 50 cal og -50 cal.
e) 0 og -50 kal.
Endringen i indre energi er direkte relatert til endringen i temperaturen. Siden prosessen er isoterm, er det ingen temperaturendring, så .
Fra termodynamikkens første lov:
Siden varme frigjøres, er tegnet negativt.
spørsmål 9
(UFRN 2012) Biomasse er en av hovedkildene til fornybar energi, og derfor er maskiner som bruker den som drivstoff for kraftproduksjon viktige fra et miljøsynspunkt. Et veldig vanlig eksempel er bruken av biomasse for å drive en dampturbin for å generere arbeid. Figuren på siden viser skjematisk et forenklet termoelektrisk kraftverk.
I dette termoelektriske anlegget produserer brenning av biomasse i ovnen varme, som varmer opp vannet i kjelen og genererer høytrykksdamp. Dampen på sin side ledes gjennom rør til turbinen som under dens virkning begynner å rotere bladene.
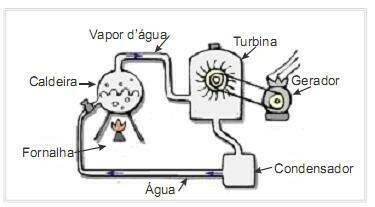
Anta at varmetap på grunn av temperaturforskjeller mellom delene av denne varmemotoren og omgivelsene er ubetydelige. I denne sammenheng variasjonen i den indre energien til kjelevannet
a) er større enn summen av varmen som tilføres den ved å brenne biomassen og arbeidet som gjøres på turbinen.
b) er lik summen av varmen som tilføres den ved å brenne biomassen med arbeidet som er utført på turbinen.
c) er lik differansen mellom varmen som tilføres den ved å brenne biomassen og arbeidet som gjøres på turbinen.
d) er større enn forskjellen mellom varmen som tilføres den ved å brenne biomassen og arbeidet som gjøres på turbinen.
Vannet i kjelen mottar energi i form av varme fra brenning av brenselet og frigjør energi i form av arbeid utført på turbinen.
spørsmål 10
(UECE 2021) Når det gjelder egenskapene til gasser, vær oppmerksom på følgende utsagn:
Jeg. For en ideell gass er intern energi kun en funksjon av trykk.
II. Varmen som absorberes av en gass når den endrer tilstand er uavhengig av prosessen.
III. Den indre energien til en ideell gass er kun en funksjon av temperaturen og er uavhengig av prosessen.
IV. I en isoterm ekspansjon av en ideell gass er arbeidet som gjøres av den lik den absorberte varmen.
Det er riktig det som står kun i
a) I og II.
b) III og IV.
c) I og IV.
d) II og III.
III. RIKTIG. Den indre energien til en ideell gass er kun en funksjon av temperaturen og er uavhengig av prosessen.
Endringen i indre energi er direkte relatert til endringen i temperaturen.
Der n er antall mol og R er den ideelle gasskonstanten, som er konstanter, kun temperaturen bestemmer den indre energien til gassen.
IV. RIKTIG. I en isoterm ekspansjon av en ideell gass er arbeidet som gjøres av den lik den absorberte varmen.
Siden det er isotermisk, er det ingen endring i temperatur, så endringen i indre energi er null. Ved termodynamikkens første lov:
Lær mer med:
- Termodynamikkens første lov
- Termodynamikk: lover, begreper, formler og øvelser
- Øvelser om termodynamikk
- gassloven
ASTH, Rafael. Øvelser av termodynamikkens første lov.All Matter, [n.d.]. Tilgjengelig i: https://www.todamateria.com.br/exercicios-da-primeira-lei-da-termodinamica/. Tilgang på:
Se også
- Øvelser om termodynamikk
- Termodynamikk
- adiabatisk transformasjon
- Øvelser om termokjemi
- Termodynamikkens første lov
- Naturvitenskap og deres teknologier: Enem
- Termisk energi
- Termodynamikkens andre lov

