O muscovius, atomnummer 115, som ligger i gruppe 15 i det periodiske systemet, er et av de siste elementene som er inkludert i det, i 2015, sammen med elementene 113, 117 og 118. Navnet er en referanse til regionen Moskva, russisk hovedstad.
Moscovium ble imidlertid opprinnelig produsert, i 2003, gjennom felles arbeid fra russiske og amerikanske forskere. Likevel, nesten 20 år etter den første syntesen, blir dens grunnleggende egenskaper fortsatt bestemt. Dermed spekuleres mye og lite er kjent om egenskapene.
Vite mer: Navn på de nye kjemiske elementene - hyllest til byer, regioner og forskere
Emner i denne artikkelen
- 1 - Sammendrag om Muscovy
- 2 - Moscovium-eiendommer
- 3 - Kjennetegn ved moscoviet
- 4 - Innhenting av Moscovium
- 5 - Muscovyens historie
- 6 - Løste øvelser på moscovium
abstrakt om moscovius
Det er et syntetisk kjemisk grunnstoff som ligger i gruppe 15 av Periodiske tabell.
Det ble syntetisert for første gang, i 2003, gjennom felles arbeid mellom russiske og amerikanske forskere.
Det utgjør gruppen av grunnstoffer som sist ble inkludert i det periodiske systemet, i 2015.
Studiene deres er svært nyere, med grunnleggende egenskaper som fortsatt blir bestemt.
Produksjonen foregår ved kjernefysisk fusjon, ved hjelp av 48Ca og atomer av 243Er.
Ikke stopp nå... Det er mer etter publisiteten ;)
Moskva eiendommer
Symbol: Mc
Atomnummer: 115
Atommasse: 288 au.m.a (ikke offisielt av Iupac)
Elektronisk konfigurasjon: [Rn] 7s2 5f14 6d10 7p3
Mest stabil isotop: 288Mc (0,159 sekunders halveringstid)
kjemisk serie: gruppe 15, supertunge elementer
Muscovy funksjoner
muscovius er et av de siste elementene inkluderts i det periodiske systemet. Inkluderingen fant sted 30. desember 2015, og det offisielle navnet ble utgitt 8. juni 2016.
Inntil den datoen var element 115 kjent på portugisisk som ununpentio, fra latin, ununpentium, hvis oversettelse er "en, en, fem". En annen nomenklatur som ble vedtatt var eka-vismut, som betyr "lik vismut", element i den sjette perioden av gruppe 15.
Muscovy er en syntetisk element, som betyr at den kun kan produseres i et laboratorium. Dette er veldig vanlig blant supertunge grunnstoffer fordi kjernen deres, med mange protoner og nøytroner, ikke kan stabilisere seg, noe som gjør det umulig å finne dem i naturen.
for å være en ustabilt element, det og de andre supertunge elementene ender opp med å gjennomgå radioaktivt forfall nesten umiddelbart - partikkelutslipp kjernefysiske elementer (som α- eller β-partikler) - og den påfølgende transformasjonen til andre lettere elementer, som kan være stabile eller Nei.
Med hensyn til det, bør det bemerkes at studiene fortsatt er svært nye, tross alt står vi overfor et element produsert for litt under 20 år siden og hvis offisielle status ikke engang er 10 år gammel. I denne forbindelse har forskere vært mer opptatt av å bestemme grunnleggende egenskaper, for eksempel deres atommasse og dens kjemiske oppførsel i noen mulige forbindelser.
For eksempel er den mest sannsynlige atommassen som er oppdaget så langt for muscovy 288 atommasseenheter. For ikke å nevne at å skaffe muscovium er veldig komplisert, med en inntekt fra bare én atom per dag.
I tillegg kan det produserte atomet ikke alltid fanges opp for å måle massen. I 2018 kunne forskere ved Berkeley Laboratories, California, USA, måle bare én masse per uke. Dermed, studier om egenskapene til forbindelsene er fortsatt innen teoretisk kjemi, med beregninger og matematiske modeller for å bestemme forventede resultater.
Anskaffelse av Muscovy
Innhenting av moscovium gjøres av Kjernefysisk fusjon. ioner av 48Her11+ (Z = 20) akselererte treff atomer av 243Am (Z = 95), arrangert i form av AmO2 på et sirkulært mål titan på 32 cm², og produserer moskoviet (Z = 115) og tre nøytroner.
Etter sammenstøtet, på omtrent et mikrosekund (10-6 sekund), treffer muscovy-atomet detektoren, som er omtrent fire meter unna kollisjonsstedet. På denne banen går elementet også gjennom en separator, slik at lettere reaksjonsprodukter avledes. I detektoren, muscovium oppdages av dets radioaktive forfallsmønster.
Moscovium, som et radioaktivt atom, gjennomgår alfa-forfall (en radioaktiv partikkel med to protoner og to nøytroner), og produserer dermed grunnstoff 113 (nihonium, Nh) til element 105 (dubnium, Db). Til slutt blir Db til rutherfordium (Rf), som raskt deler seg i to fragmenter. Forfallsmønsteret til moscovium er vist nedenfor.
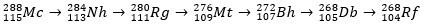
Moskvas historie
muscovius var første gang syntetisert i 2003, mellom 14. juli og 10. august, gjennom felles arbeid av forskere fra Joint Institute for kjernefysisk forskning i Dubna, Russland, og Lawrence Livermore National Laboratory i Livermore, California.
Ioner av 48Ca slik at de kunne kollidere med atomer av 243Am, produserte først isotopen 291Mc. Under prosessen ble kjernen varmet opp til utrolige 4 x 1011 K, og deretter avkjølt av den svært raske emisjonen av tre nøytroner og gammastråler.

Denne handlingen dannet isotopen 288Mc. deretter moscovius ble oppdaget og analysert basert på mønsteret av radioaktive henfall (alfaforfall). Navnet Moskow er en hyllest til Moskva-regionen, Russland.
Les også:Seaborgium - det syntetiske kjemiske elementet oppkalt etter forskeren Glenn Seaborg
Løste øvelser på muscovius
Spørsmål 1
Moscovium, et nylig oppdaget grunnstoff, ble plassert i gruppe 15 i det periodiske system. Basert på de andre elementene i denne gruppen, vil det forventede hydridet for dette elementet være:
A) McH
B) McH2
C) McH3
D) McH4
E) Mc2H3
Vedtak:
Alternativ C
Andre gruppe 15 elementer, som f.eks nitrogen Det er fosfor, presentere formlene NH3 og pH3 når de er bundet til hydrogen. Dermed forventes det at moscovium presenterer formelen McH3 også.
spørsmål 2
I 2003 ble moscovium (Z = 115) syntetisert for første gang, gjennom felles arbeid fra russiske og amerikanske forskere. På den tiden, isotopen 288Mc ble oppdaget og produksjonen var avgjørende for å plassere dette elementet i det periodiske systemet. Antall nøytroner i denne isotopen er:
A) 115
B) 288
C) 403
D) 173
E) 170
Vedtak:
Alternativ D
Antallet av nøytroner kan beregnes slik:
A = Z + n
Der A er massetallet, Z er atomnummeret, og n er antall nøytroner. Ved å erstatte verdiene får vi:
288 = 115 + n
n = 288 – 115
n = 173
Av Stefano Araujo Novais
Kjemilærer
Har du noen gang hørt om det kjemiske elementet antimon? Klikk her og lær om dens egenskaper, egenskaper, innhenting, applikasjoner og historie.
Har du noen gang hørt om det kjemiske elementet arsen? Klikk her, lær om hovedfunksjonene og finn ut hvilke forholdsregler som bør tas med den.
Har du noen gang hørt om det kjemiske elementet vismut? Klikk her og lær om dens egenskaper, egenskaper, innhenting, applikasjoner og historie.
Oppdag hva transuraniske elementer syntetisert i laboratoriet er, hvordan de ble oppdaget og deres plassering i det periodiske systemet.
Lær mer om fosfor så vel som dets egenskaper, egenskaper, bruksområder, forholdsregler, betydning og historie, samt fosforsyklusen.
Klikk og kjenn historien, egenskapene, kildene, måtene å oppnå og bruken av nitrogen på.
Lær i denne teksten hva de nye kjemiske elementene heter og hvorfor hver enkelt har fått slike navn.
Oppdag hovedkarakteristikkene til de fire nye elementene i det periodiske systemet.
