DE isomerisme det er et fenomen som observeres når forskjellige forbindelser dannes av like mengder av de samme typene atomer.
Derfor kan vi finne kjemiske stoffer med samme molekylformel og forskjellige strukturformler eller romlige arrangementer.
Dette fenomenet er mye observert i organisk kjemi, som studerer karbonforbindelser. Siden hvert atom i dette elementet kan lage 4 kjemiske bindinger, er det mulig å observere forskjellige kombinasjoner.
Ettersom endringen i arrangementet av atomer gir opphav til nye stoffer, har de derfor forskjellige fysiske og kjemiske egenskaper.
Når vi sier hvilke forbindelser som er isomerer betyr at de har like deler, siden ordet er en kombinasjon av to termer med gresk opprinnelse: isos, betyr "virkelig", og bare, som er "deler".
De to hovedgruppene av isomerisme er plan og rom (stereoisomerisme).
DE flat isomeri den kan visualiseres av den flate strukturformelen til forbindelsene og har fem klasser: posisjon, funksjon, kjede, kompensasjon og tautomeri.
DE romisomerisme
det observeres ved orienteringen av forbindelsene og er delt inn i geometrisk (cis-trans) og optisk.Begrepet isomerisme ble introdusert i 1830 av den svenske vitenskapsmannen Jacob Berzelius.
Eksempler på isomerer
DE kjedeisomerisme det oppstår når det samme settet med atomer kobles sammen for å danne strukturer av samme funksjonelle gruppe, men med forskjellige kjeder.
Eksempel: molekylformelen C4H10 av et hydrokarbon kan være rett eller forgrenet.

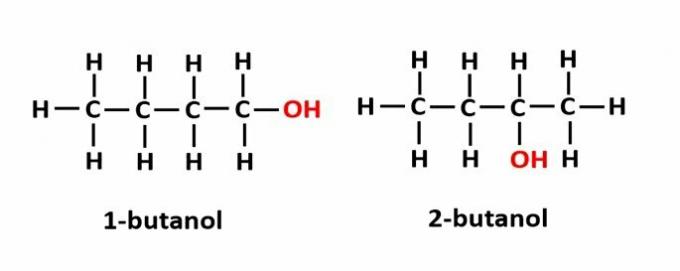
DE posisjon isomeri oppstår når forbindelser dannes av de samme funksjonelle gruppene, men de er på forskjellige posisjoner i kjeden.
Eksempel: Molekylformelen C4H9OH tilsvarer to typer alkohol.
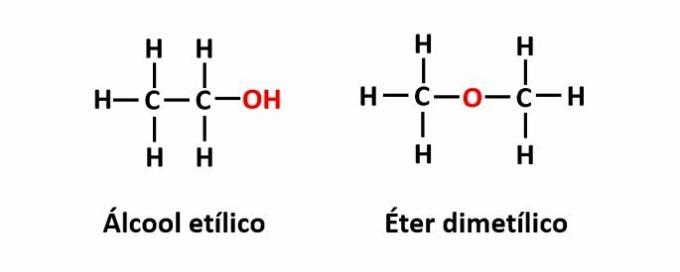
DE funksjon isomeri oppstår når samme molekylformel tilsvarer to forbindelser med forskjellige funksjonelle grupper.
Eksempel: Molekylformelen C2H6O tilsvarer to isomerer som har funksjonene alkohol (-OH) og eter (-O-).
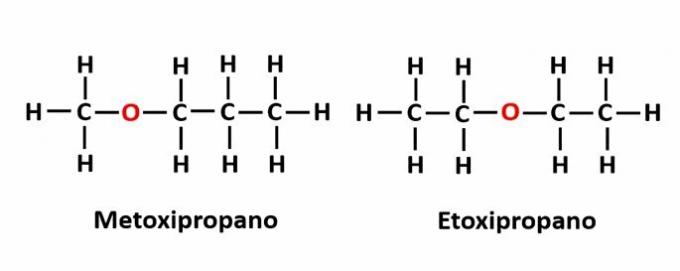
DE kompensasjonsisomerisme det oppstår når det er et heteroatom i kjeden og det opptar forskjellige posisjoner. Dette er et spesielt tilfelle av posisjonsisomeri.
Eksempel: Molekylformelen C4H10Den indikerer tilstedeværelsen av et oksygenatom i kjeden, men dens posisjon kan endres og danne forskjellige forbindelser.
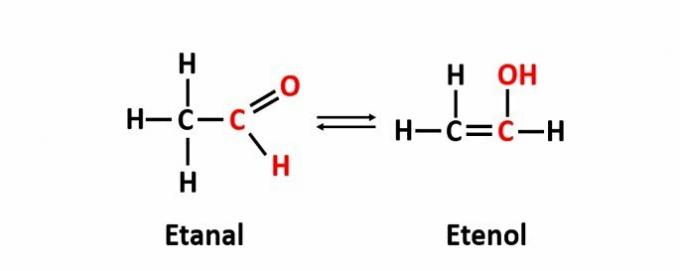
DE dynamisk isomeri, også kalt tautomeri, oppstår når to forbindelser med forskjellige funksjoner er i samme løsning i dynamisk likevekt. Dette er et spesielt tilfelle av funksjonsisomeri.
Eksempel: Molekylformelen C2H4O tilsvarer forbindelser med aldehyd- og enolfunksjonene.
Lære mer om flat isomeri.
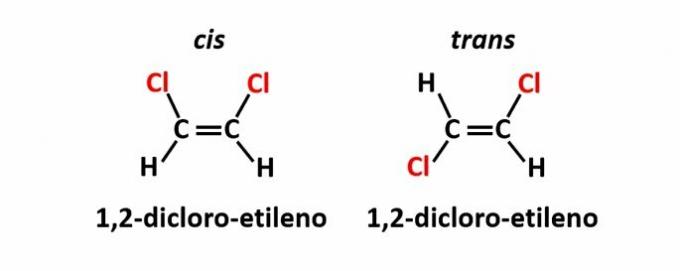
DE geometrisk isomeri, også kalt isomeri cis-trans, oppstår når tilstedeværelsen av en dobbeltbinding eller syklisk struktur får like ligander til å være på samme side av planet (cis) eller på motsatte sider (trans).
Eksempel: kloratomene i forbindelser med molekylformel C2H2Cl2 de kan ha to romlige strukturer.
DE optisk isomeri oppstår når forbindelsene klarer å avlede strålen når de avleder det polariserte lyset som sendes ut på strukturen lysende til venstre, hvis det er en venstredreiende (l) isomer, eller til høyre, når det er en høyredreiende isomer (d).
Eksempel: Denne typen isomerisme oppstår med melkesyre. Merk nedenfor at spektralbildene av isomerene ikke overlapper hverandre, derfor kalles de enantiomerer.
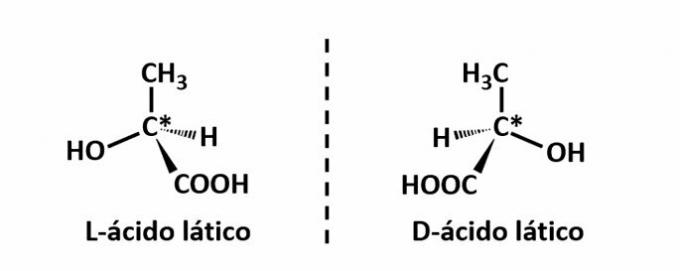
Symbolet C* indikerer tilstedeværelsen av et kiralt karbon i denne strukturen, dvs. et karbonatom med 4 forskjellige linkere.
Lær mer om isomeri med innholdet:
- Typer isomeri
- romisomer
- geometrisk isomer
- optisk isomer
- Øvelser om planisomerisme



