Denne blandingen av gasser gir opphav til homogene blandinger eller gassformige løsninger. For eksempel spres gassene som kommer ut av fabrikkskorsteiner, eller bileksos, gjennom luften atmosfæriske, og med tiden var vi ikke i stand til å skille dem lenger, da det var en diffusjon av disse gassene gjennom luft.

Gassene som slippes ut av skorsteinene spres og "tapes" i den atmosfæriske luften, fordi luftvolumet er mye større enn røykens.
| DE spredning av en gass er en spontan bevegelse av en gass gjennom en annen, det vil si at den sprer seg i et annet gassformig medium. |
| DE effusjon av gasser er en spesiell type diffusjon, der det er lekkasje av gasser gjennom små hull (eller porøse vegger, som er et sett med små hull). |
For eksempel er ballonger som selges til barn fylt med heliumgass. Over tid ender denne gassen opp med å passere gjennom ballongens gummiporer, det vil si at det er dens effusjon. Dette vises ved at ballongen tømmes etter noen timer.
Den skotske kjemikeren Thomas Graham studerte i 1829 denne oppførselen til gasser. Han konkluderte med at hastigheten som en gass diffunderer eller strømmer ut i en annen er relatert til dens tetthet. Da hans eksperimentelle data ble gjentatt for alle gasser, skapte han følgende lov som bærer navnet hans:
Grahams lov: hastigheten for diffusjon eller effusjon av en gass er omvendt proporsjonal med kvadratroten av dens tetthet.
Matematisk kan denne loven uttrykkes ved ligningen:
v α 
Eller, relatert til to forskjellige gasser, har vi:
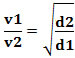
Enheten som brukes i dette tilfellet er "volumet som slipper ut per tidsenhet"; derfor generelt L/min (liter per minutt).
Dermed diffunderer gasser med lavere tetthet raskere. Hvis den er i samme temperatur- og trykktilstand, kan du også lage en sammenheng av dette med massen gassmolar: jo større tetthet gassen har, jo større er dens molare masse og jo lavere hastighet spredning; og vice versa. Dermed har vi:
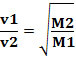
Av Jennifer Fogaça
Uteksaminert i kjemi
Brasil skolelag
Kilde: Brasil skole - https://brasilescola.uol.com.br/quimica/difusao-efusao-dos-gases.htm

