DE entalpi er en termodynamisk funksjon som beregner varmen involvert i isobariske prosesser, det vil si som holdes under konstant press. Utviklingen fant sted kort tid etter fallet av kaloriteorien, med fremgangen av termodynamikk mellom årene 1840 og 1850.
Entalpien, for hvaumica, har ikke så mye betydning hvis den brukes som en absolutt og isolert verdi, men det har den når man vurderer variasjon av dens verdi i en kjemisk prosess. Det er flere måter å beregne entalpivariasjonen til en prosess, de viktigste er gjennom dannelses-, bindings- og også ved derhei fra hess.
Les også: Hva er Gibbs Free Energy?
Entalpi sammendrag
Entalpi er et termodynamisk verktøy for å beregne varmen involvert i prosesser som skjer ved konstant trykk.
Det ble definert av den amerikanske fysikeren Josiah W. Gibbs, i sammenheng med kaloriteoriens fall.
I kjemi bruker vi alltid entalpiendringen, representert som ΔH.
Kjemiske reaksjoner som absorberer varme kalles endoterme og har ΔH > 0.
Kjemiske reaksjoner som frigjør varme kalles eksoterme og har ΔH < 0.
Video leksjon om entalpi
Hva er entalpi?
Entalpien, alltid representert ved H, var opprinnelig definert av den amerikanske fysikeren Josiah Willard Gibbs, som han kalte funksjonen varme ved konstant trykk, siden, med hans ord:
"[...] nedgangen i funksjon representerer, i alle tilfeller der trykket ikke varierer, varmen som gis fra systemet."
Fra Gibbs' arbeid kan vi altså forstå entalpi som en termodynamisk funksjon hvis variasjon er numerisk lik mengden varme som utveksles i systemet, til press konstant. Dette betyr at i isobariske prosesser (som de fleste kjemiske prosesser), å vite beregne variasjonen av entalpifunksjonen, kan man da vite verdien av varmevekslet mellom system og nabolag.

En slik sammenheng med varme forårsaker mange elever tror feilaktig at entalpi er synonymt med varme eller noe som energiinnhold, varmeinnhold, frigjort varme og absorbert varme og lignende.
Entalpien oppsto i sammenheng med kollapsen av kaloriteorien, som behandlet varme som et uoversiktlig materiell stoff som ble overført fra varmere kropper til kaldere kropper. Dermed ble det behov for et nytt verktøy for å beregne varme. Løsningen var da å bruke mengder som allerede hadde definerte termodynamiske ligninger, for eksempel entalpi.
Les også: Hvordan beregne entalpiendringen av løsning?
entalpivariasjon
Siden entalpi er et verktøy som brukes til å beregne varmen som utveksles i en kjemisk prosess, gir det ingen mening å bruke det som et absolutt, isolert tall, men med tanke på variasjonen, det vil si at vi i praksis bare bør vurdere hvor mye, numerisk, entalpien endret seg under den kjemiske prosessen, siden termodynamikken forsikrer oss om at dens variasjon er numerisk lik varmen som frigjøres eller absorberes i prosessen.
Strengt tatt kan vi definere entalpivariasjonen som:
ΔH = HEndelig - Hførste
Som i kjemiske prosesser, kan det siste trinnet betraktes som produktene og det første trinnet kan betraktes som reagensene. Det er også vanlig å se definisjonen av entalpivariasjon som:
ΔH = HProdukter - Hreagenser
Fra et praktisk og fortolkende synspunkt, hvis entalpiendringen er positiv (ΔH> 0), sier vi at den kjemiske reaksjonen er endotermisk, det vil si at det er varmeabsorpsjon gjennom hele prosessen. Allerede hvis entalpiendringen er negativ (ΔH< 0), sier vi at den kjemiske reaksjonen er eksotermisk, det vil si at varme frigjøres gjennom hele prosessen.
Entalpivariasjonen er i mange tilfeller observert i grafer, som vist i de følgende eksemplene.
Eksempel 1:
Endotermisk reaksjonsdiagram
I entalpigrafene for endoterme reaksjoner kan man se at mengden entalpi til produktene er større enn for reaktantene, noe som indikerer at variasjonen langs reaksjonen er positiv. Således, hvis ΔH > 0, kan vi si at den kjemiske prosessen skjedde med varmeabsorpsjon.
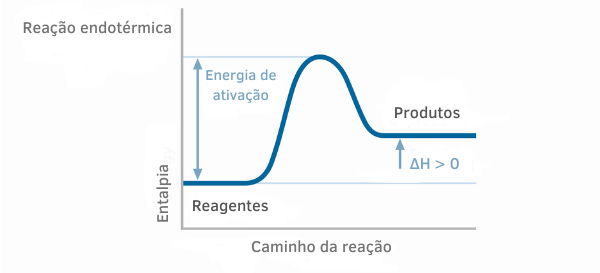
Eksempel 2:
Eksotermisk reaksjonsdiagram:
I entalpigrafene for eksoterme reaksjoner kan man se at mengden entalpi til produktene er mindre enn reaktantene, noe som indikerer at variasjonen langs reaksjonen er negativ. Med ΔH < 0 kan vi si at den kjemiske prosessen skjedde med frigjøring av varme.
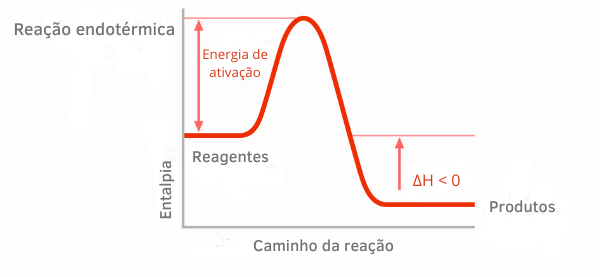
Les mer om disse klassifiseringene av kjemiske reaksjoner i teksten: TILendoterme og eksoterme prosesser.
Typer entalpi
formasjonsentalpi
DE formasjonsentalpi é regnet ut basert på danner kjemiske reaksjoner, som er reaksjoner der en mol sammensatte stoffer dannes fra deres mest stabile enkle stoffer ved romtemperatur og 1 atmosfæres trykk.
H2(g) + ½ O2 (g) → H2O (l) H°f = -286 kJ/mol
Den store fordelen med dannelsesentalpien er at enkle stoffer som er mer stabile ved romtemperatur og 1 atmosfære trykk har en entalpi avtalt til null. Dette er ikke å si at de faktisk er null, men for forenkling og bedre klassifisering blir de behandlet slik.
Å være H = HProdukter - Hreagenser, hvis vi tenker på at Hreagenser = 0, kan vi si at den observerte verdien av ΔH bare er relatert til produktene, som i disse tilfellene alltid er en mol av det sammensatte stoffet. Derfor tabeller vi denne verdien som standard entalpivariasjonen av vanndannelse, representert ved ΔH°f.
Det var med denne metodikken flere stoffer hadde sine variasjoner av standard entalpi formasjonstabeller, som vi kan se nedenfor.
Substans |
Formasjonsentalpi (ΔH°f) i kJ/mol |
CO2 (g) |
-393,4 |
CaO(er) |
-634,9 |
HI(g) |
+25,9 |
NEI (g) |
+90,1 |
bindende entalpi
Bindingsentalpien tjener til å indikere mengden energi som er involvert i brudd eller dannelse av en gitt føflekk. kjemisk forbindelse.
Det er forstått at, for å bryte en kjemisk binding, er det nødvendig å absorbere varme, slik at bindingsatomene øker deres indre energi og følgelig øke din kinetiske energi. med større kinetisk energi, vibrerer atomene mer intenst, noe som får bindingene til å bryte. Derfor er hver bindingsbrudd en endoterm prosess.
Ellers, for å danne en kjemisk binding, mister atomer bevegelsesfrihet og må redusere bevegelsesgraden, noe som reduserer den kinetiske energien. Overskuddsenergien frigjøres da i form av varme. Og dermed, all bindingsdannelse er en eksoterm prosess.
Tabellen nedenfor viser verdiene av energiene knyttet til hver kjemisk binding.
Forbindelse |
Bindingsenergi (kJ/mol) |
C-H |
412,9 |
C-C |
347,8 |
O═O |
497,8 |
F-F |
154,6 |
NEI |
943,8 |
Merk at det ikke er noen tegn i verdiene, da de er i modul. Dette er fordi signalet må tildeles av deg avhengig av om koblingen er brutt eller dannet.
Forbrenningsentalpi
DE forbrenningsentalpi tjener til å indikere mengde varme som frigjøres ved forbrenning av en mol av et stoff. Det skal bemerkes at hver forbrenningsreaksjon er eksoterm, da hver forbrenning frigjør varme.
CH4 (g) + 2 O2 (g) → CO2 (g) + 2 H2ΔH°Ç = -889,5 kJ/mol
Tabellen nedenfor viser entalpi av forbrenningsverdier for enkelte kjemiske stoffer.
Substans |
Forbrenningsentalpi (ΔH°Ç) i kJ/mol |
Etanol - C2H5OH (1) |
-1368 |
Benzen - C6H6 (1) |
-3268 |
Oktan - C8H18 (1) |
-5471 |
Glukose - C6H12O6 (s) |
-2808 |
Entalpi av fysisk tilstandsendring
Hver endring i fysisk tilstand innebærer varmeveksling. derfor entalpi for endring av fysisk tilstand tjener til å indikere mengde varme involvert i fysiske tilstandsendringsprosesser.
For eksempel har vi vannfordampning:
H2O (1) → H2O (g) ΔH = +44 kJ/mol
Ved smelting av vann har vi:
H2O(s) → H2O (l) ΔH = +7,3 kJ/mol
Entalpiverdier er symmetriske for inverse prosesser, som betyr at for eksempel entalpiendringen i flytendegjøringen av vann er -44 kJ/mol, mens den ved størkning er lik -7,3 kJ/mol.
Les også: Hva er entropi?
Løste øvelser om entalpi
Spørsmål 1 - (UERJ 2018) Den forurensende kapasiteten til et hydrokarbon brukt som drivstoff bestemmes av forholdet mellom energien som frigjøres og mengden CO2 dannet i dens fullstendige forbrenning. Jo høyere forhold, desto lavere forurensingskapasitet. Tabellen nedenfor viser standardentalpien for forbrenning av fire hydrokarboner.

Fra tabellen er hydrokarbonet med den laveste forurensende kapasiteten:
Oktan
Heksan
Benzen
pentan
Vedtak
Alternativ D
Spørsmålet indikerer at den forurensende kapasiteten er definert som forholdet (kvotienten) mellom energien som frigjøres og mengden CO2 dannet i dens fullstendige forbrenning. Jo større Årsaken, jo lavere forurensende kapasitet, det vil si at det frigjøres mer energi per mol CO2 generert.
De fullstendige forbrenningsreaksjonene av Hydrokarboner sitert er:
Oktan: Ç8H18 +25/2 O2 → 8 CO2 + 9 timer2Årsaken: 5440/8 = 680
Heksan: Ç6H14 +19/2 O2 → 6 CO2 + 7 timer2Årsaken: 4140/6 = 690
Benzen: Ç6H6 + 15/2 O2 → 6 CO2 + 3 H2Årsaken: 3270/6 = 545
pentan: Ç5H12 + 8 O2 → 5 CO2 + 6 H2Årsaken: 3510/5 = 702
Dermed kan vi konkludere med at pentan er hydrokarbonet med lavest forurensende kapasitet.
Spørsmål 2 - (Enem 2015) Bruken av skogrester blir mer attraktiv for hver dag, siden de er en fornybar energikilde. Figuren representerer brenning av en bioolje utvunnet fra treavfall, hvor ΔH1 entalpivariasjonen på grunn av forbrenning av 1 g av denne biooljen, noe som resulterer i karbondioksid og flytende vann, og ΔH2 entalpiendringen involvert i omdannelsen av 1 g vann i gassform til flytende tilstand.

Entalpivariasjonen, i kJ, for forbrenning av 5 g av denne biooljen, noe som resulterer i CO2 (gassformig) og H2Den (gassformige) er:
A) -106
B) -94
C) -82
D) -21,2
E) -16,4
Vedtak
Alternativ C
Fra den viste grafen har vi ΔH1 som entalpivariasjonen av biooljebrenning som produserer CO2 (g) og H2O (1) og AH2 som entalpiendringen av flytende vann, siden CO2 forblir gassformig og bare den fysiske tilstanden til Vann endringer (fra gass til væske).
Øvelsen ber om entalpiendringen ved å brenne 5 g bioolje, noe som resulterer i CO2 (gassformig) og H2O (gassformig). Fra diagrammet kan denne entalpiendringen defineres som ΔH = ΔH1 – H2. Dermed vil verdien av ΔH være lik -16,4 kJ/g. Denne variasjonen, som vi kan se i enheten, er for HVERT gram bioolje. For 5 gram må vi gjøre proporsjon:
1 g bioolje -16,4 kJ
5 g bioolje x
1. x = 5. (-16,4)
x = -82 kJ
Vi kan da markere alternativ C.
Av Stéfano Araújo Novais
Kjemilærer
