Kps er akronymet som brukes til å representere løselighetsprodukt konstant, som refererer til produktet (multiplikasjon) av konsentrasjoner i mengde materie av ionene som er tilstede i en løsning.
Hver gang en dårlig løselig løsemiddel tilsettes et løsningsmiddel som bariumsulfat, en liten mengde en del av dette saltet løses opp i vannet, og resten akkumuleres i bunnen av beholderen og danner kroppen av bakgrunn. Saltet som løses opp lider dissosiasjon, slipper kationer og anioner i vannet.

Nedbør tilstede i en løsning med vann og bariumsulfat
I tillegg til at salt ikke gir bra løselighet, endres ikke mengden oppløst løsemiddel over tid fordi det er en oppløsningsvekt mellom saltionene (tilstede i løsningen) og bakgrunnslegemet.

BaSO oppløsningsbalanse4 i vann
Kps av en løsemiddel
O Kps av en oppløst stoff er produktet av molare konsentrasjoner av de deltakende ionene. Det er alltid nødvendig å heve ionekonsentrasjonen til sin respektive støkiometriske koeffisient (brukes til å balansere ligningen).

Oppløsningsvekt av elektrolytt YDeXB
O Kps av den foreslåtte likevekten for salt YDeXB den vil ha konsentrasjonen av reagens Y (hevet til sin støkiometriske koeffisient (a) og konsentrasjonen av produkt X (hevet til sin støkiometriske koeffisient (b)).
Kps = [Y+ b]De. [X-De]B
Eksempel
Anta at vi forbereder en løsning med vann og aluminiumcyanid [Al (CN)3], som er et praktisk talt uløselig salt i vann. Når dette saltet tilsettes vann, ender det opp med fenomenet dissosiasjon.

Al (CN) elektrolyttoppløsningsvekt3
Så, gjennom ligningen av likevekten av saltoppløsning, har vi det Kps vil ha multipliseringen av konsentrasjonen av aluminiumskationen (Al+3) hevet til eksponent 1 ved konsentrasjonen av cyanidanion (CN-1) hevet til eksponent 3.
Kps = [Al+3]1. [CN-1]3
Kps betydninger av løsemiddel
Når vi finner Kps av et bestemt salt blandet med vann, kjenner vi også konsentrasjonen av hvert av ionene i løsningen. Med disse dataene kan vi bestemme rangeringen av en løsning eller oppløsningen til løsemidlet i løsningen. Vurder følgende balanse:

Oppløsningsvekt av elektrolytt YDeXB
Vi kan lage følgende forhold:
Hvis Kps = [Y+ b]De. [X-De]B = 0, vi har en mettet løsning uten tilstedeværelse av bunnfall;
Hvis Kps> [Y+ b]De. [X-De]B = 0, har vi en umettet løsning, det vil si en lav mengde oppløst stoff oppløst i løsningsmidlet (i forhold til løselighetskoeffisient);
Hvis Kps + b]De. [X-De]B = 0, vi har en mettet løsning med en bunnlegeme, det vil si at det vil komme en utfelling av elektrolytten (oppløst stoff);
Hvis Kps-verdien til elektrolytten er for lav, er det et lite løselig materiale i løsningsmidlet.
Eksempel av Kps-beregning av en løsemiddel
(UERN): Løseligheten av kalsiumnitrat [Ca (NO3)2] i vann er 2,0. 10–3 mol / liter ved en bestemt temperatur. Kps av dette saltet ved samme temperatur er:
a) 8.10–8.
b) 8.10–10.
c) 3.2.10–10
d) 3.2.10–8
Treningsdata:
Saltformel: Ca (NO3)2;
Molarsaltkonsentrasjon (løselighet): 2,0. 10–3 mol / L.
For å løse og beregne Kps, må du gjøre følgende:
Trinn 1: Sett opp saltoppløsningsbalansen.
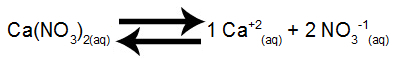
Oppløsningsvekt i kalsiumnitrat i vann
Kalsiumnitrat frigjør 1 mol kalsiumkationer ved dissosiasjon i vann+2) og 2 mol nitratanioner (NO3-1).
Steg 2: Sett sammen uttrykket til saltet Kps
Kps av dette saltet vil være produktet av kalsiumkationkonsentrasjonen hevet til eksponent 1 ved konsentrasjonen av nitratanionet hevet til eksponent 2, som vist nedenfor:
Kps = [Ca+2]1.[PÅ3-1]2
Trinn 3: Bestem verdiene til ionkonsentrasjoner i løsningen
For å beregne Kps trenger vi verdiene til ionkonsentrasjonene, men øvelsen ga molariteten til saltet i løsningen. For å bestemme konsentrasjonen av hvert ion, multipliserer du bare molariteten til saltet med den støkiometriske koeffisienten til deltakeren i reaksjonen:
For kalsiumkation:
[Her+2] = 1. 2,0. 10–3
[Her+2] = 2,0. 10–3 mol / L.
For nitratanionen:
[PÅ3-1] = 2. 2,0. 10–3
[PÅ3-1] = 4,0. 10–3 mol / L.
Trinn 4: Bruk konsentrasjonsverdiene som er funnet i trinn 3 i Kps-uttrykket (bestemt i trinn 2).
Kps = [Ca+2]1.[PÅ3-1]2
Kps = [2.10-3]1.[4.10-3]2
Kps = 2.10-3.16.10-6
Kps = 32,10-9
eller
Kps = 3.2.10-9 (mo / l)
Av meg. Diogo Lopes Dias
Kilde: Brasilskolen - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-kps.htm


