Organisk kjemi er et bredt område innen kjemi som studerer karbonforbindelser.
Kunnskapen om organisk kjemi blir kontaktet på flere måter, og når vi tenker på det, har vi satt sammen foreslåtte øvelser, opptaksprøver og Enem-spørsmål for å teste din kunnskap.
Bruk også oppløsningskommentarene for å lære enda mer om emnet.
Foreslåtte øvelser
Spørsmål 1
Se på de organiske forbindelsene nedenfor og identifiser de organiske funksjonene i henhold til de uthevede funksjonelle gruppene. Etter det, navngi stoffene.
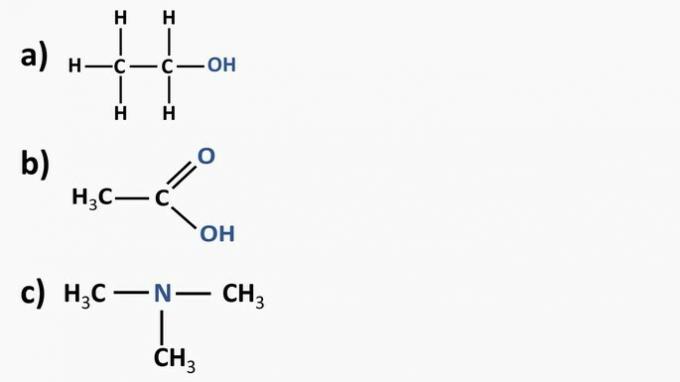
Svare:
a) Organisk forbindelse: etanol
- organisk funksjon: alkohol
- Generell formel: R — OH
- Identifikasjon: hydroksyl (OH) knyttet til karbonkjeden
b) Organisk forbindelse: etansyre.
- Organisk funksjon: karboksylsyre
- Generell formel: R — COOH
- Identifikasjon: karboksylradikal (COOH) knyttet til karbonkjeden
c) Organisk forbindelse: trimetylamin
- Organisk funksjon: amin (tertiær)
- Generell formel:
- Identifikasjon: nitrogen knyttet til tre karbonkjeder
spørsmål 2
I organisk kjemi gjenkjennes forbindelser av kjedene dannet av karbon og hydrogen. Imidlertid kan andre elementer være en del av den kjemiske strukturen til disse forbindelsene, for eksempel oksygen.
Velg alternativet der de to organiske forbindelsene har oksygenerte organiske funksjoner.
a) kloroform og etylmetaneat
b) propanol og propansyre
c) eten og etandiol
d) ethanamid og benzen
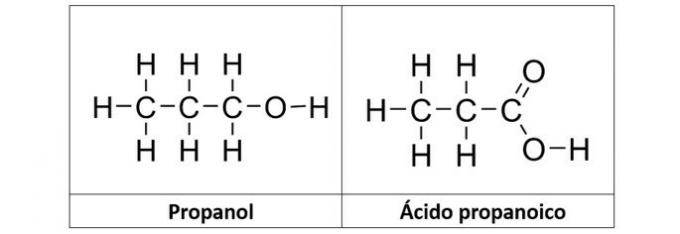
Riktig svar: b) propanol og propansyre
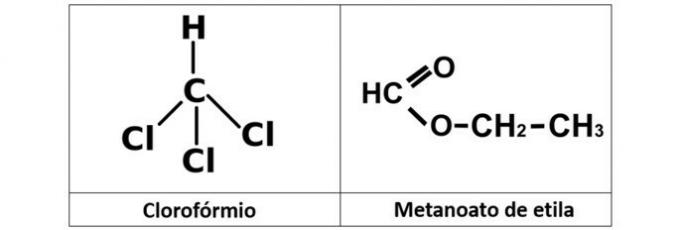
a) FEIL. Vi har kloroform (CHCl3), som er et alkylhalogenid, og etylmetanoatesteren (C3H6O2), som inneholder oksygen i strukturen.
b) KORREKT. I dette alternativet har vi to forbindelser som har oksygenerte organiske funksjoner. Propanol (C3H8O) er en alkohol dannet av tre karbonatomer. Propansyren (C3H6O2) er en karboksylsyre.
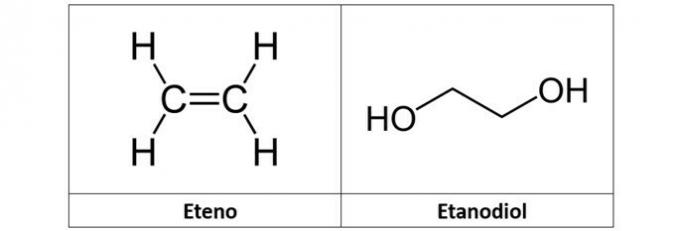
c) FEIL. Etylenet (C2H4), også kalt etylen, er et hydrokarbon av alken-type. Allerede etandiol (C2H6O2) er en alkohol med to hydroksyler i strukturen.
d) FEIL. Etanamid (C2H5NO) er et amid og benzen er et aromatisk hydrokarbon og er derfor bare dannet av karbon og hydrogen.

spørsmål 3
Se på strukturen til den organiske forbindelsen nedenfor og sjekk de sanne utsagnene.

(01) Forbindelsen har en organisk nitrogenfunksjon.
(02) Det er et primært amin, da det bare er knyttet til ett hydrogen.
(03) Navnet på forbindelsen er dietylamin.
Riktig svar:
(01) KORREKT. Den nitrogenholdige organiske funksjonen som er tilstede i forbindelsen er amin.
(02) FEIL. Det er et sekundært amin, ettersom nitrogen er knyttet til to karbonkjeder.
(03) FEIL. Forbindelsens navn er dimetylamin, da det er to metylradikaler festet til nitrogen.
spørsmål 4
Eugenol, et medlem av fenylpropanoidfamilien, er en aromatisk organisk forbindelse som er tilstede i nellik, et krydder brukt siden antikken.

Observer strukturformelen til forbindelsen og identifiser de tilstedeværende organiske funksjonene.
a) Alkohol og eter
b) Fenol og eter
c) Alkohol og ester
d) Fenol og ester
e) Alkohol og hydrokarbon
Riktig alternativ: b) Fenol og eter.
Eugenol har oksygenerte organiske funksjoner i kjeden, det vil si i tillegg til karbon- og hydrogenatomer, oksygen er et heteroatom.
Den organiske fenolfunksjonen er preget av hydroksyl (-OH) festet til en aromatisk ring. I eterfunksjonen er oksygen plassert mellom to karbonkjeder.
spørsmål 5
EDTA, hvis fulle navn er etylendiamintetraeddiksyre, er en organisk forbindelse med mange bruksområder. Dens evne til å binde metallioner gjør det til et chelateringsmiddel som er mye brukt både i laboratoriet og industrielt.
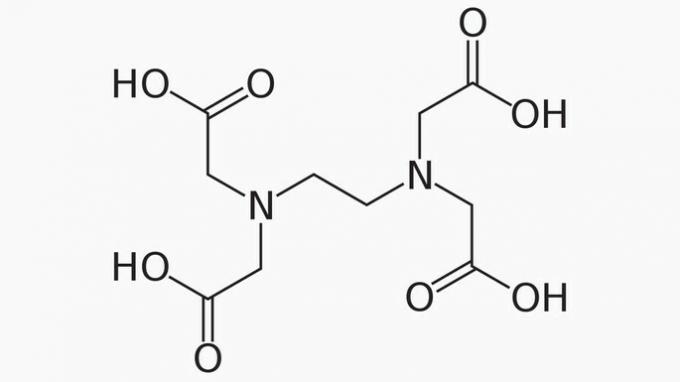
Om EDTA er det riktig å si at karbonkjeden er:
a) Åpen, homogen og umettet.
b) Lukket, heterogent og mettet.
c) Åpen, heterogen og umettet.
d) Lukket, homogent og mettet.
e) Åpen, heterogen og mettet.
Riktig svar: e) Åpent, heterogent og mettet.
EDTA-kjeden er klassifisert i:
ÅPEN. I henhold til arrangementet av karbonatomer i strukturen til EDTA kan vi se at kjeden av forbindelsen åpnes på grunn av tilstedeværelsen av ender.
HETEROGEN. I tillegg til karbon- og hydrogenforbindelser har karbonkjeden nitrogen- og oksygenheteroatomer.
METTET. Bindinger mellom karbonatomene er mettede, da kjeden bare har enkeltbindinger.
Lær mer på: Organisk kjemi.
opptaksprøver spørsmål
Spørsmål 1
(UFSC) Observer de ufullstendige organiske strukturene og identifiser de riktige elementene:
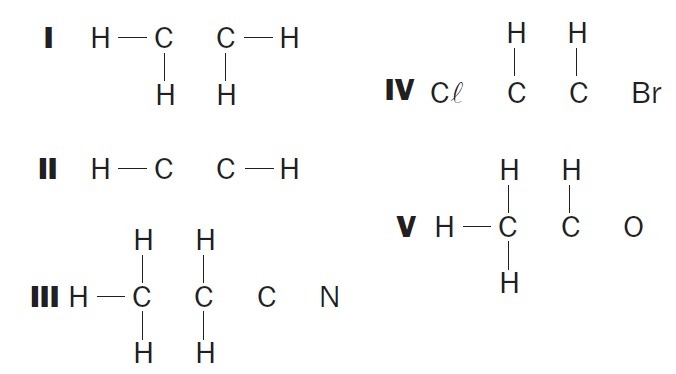
(01) Struktur I mangler en enkelt binding mellom karbonatomer.
(02) Struktur II mangler en trippelbinding mellom karbonatomer.
(03) Struktur III mangler to enkeltbindinger mellom karbonatomer og en trippel mellom karbon og nitrogenatomer.
(04) Struktur IV mangler to enkeltbindinger mellom karbonatomer og halogener og en dobbeltbinding mellom karbonatomer.
(05) Struktur V mangler en enkeltbinding mellom karbonatomer og en enkeltbinding mellom karbon og oksygenatomer.
Korrekte alternativer: 02, 03 og 04.
I tillegg til karbon, et obligatorisk kjemisk element i organiske forbindelser, kan andre elementer være tilstede i strukturer og bundet av kovalente bindinger, der elektroner deles.
Elementenes valens bestemmer antall bindinger som kan dannes, som vist i tabellen nedenfor.
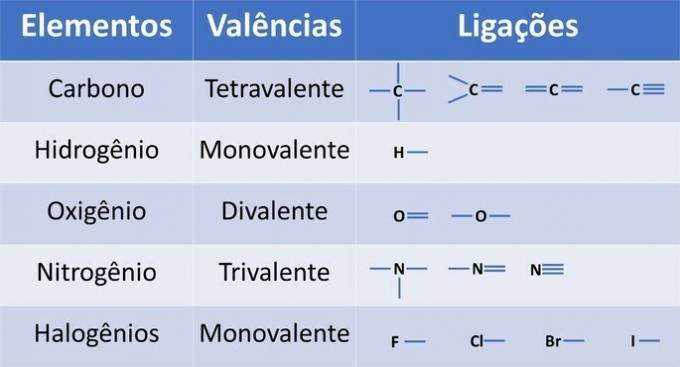
Fra denne informasjonen har vi:
(01) FEIL. Strukturen mangler en dobbeltbinding mellom karbonatomer for å danne etenforbindelsen.
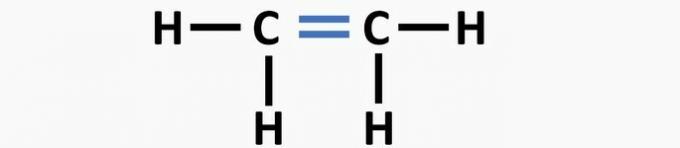
(02) KORREKT. Strukturen mangler en trippelbinding mellom karbonatomer for å danne etyneforbindelsen.
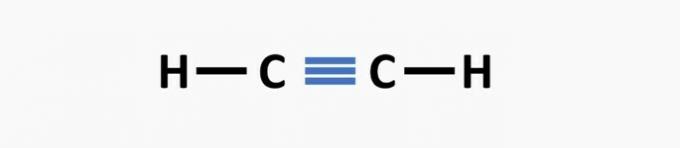
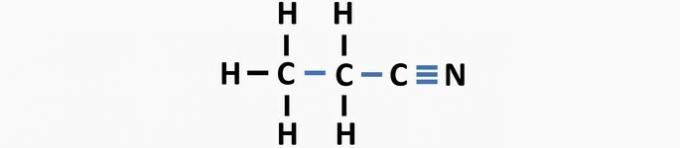
(03) KORREKT. Strukturen mangler enkeltbindinger mellom karbon og trippelbindinger mellom karbon og nitrogen for å danne forbindelsen propanenitril.
(04) KORREKT. Strukturen mangler enkeltbindinger mellom karbon og halogen, og dobbeltbindinger mellom karbon for å danne dikloretenforbindelsen.
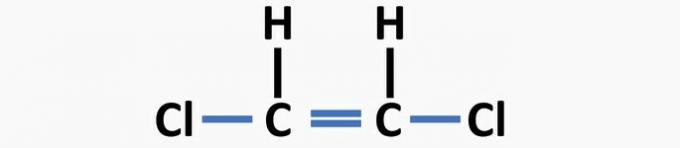
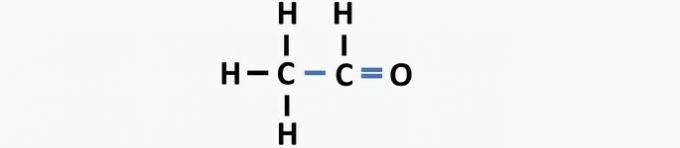
(05) FEIL. Strukturen mangler en enkeltbinding mellom karbonatomer, og en dobbeltbinding mellom karbon og oksygen for å danne etanolforbindelsen.
spørsmål 2
(UFPB) Strukturen til den organiske forbindelsen med molekylformel C5H8Det som presenterer en forgrenet, umettet, heterogen og alisyklisk kjede er:

Riktig alternativ: d.
Kullkjeder kan klassifiseres som følger:
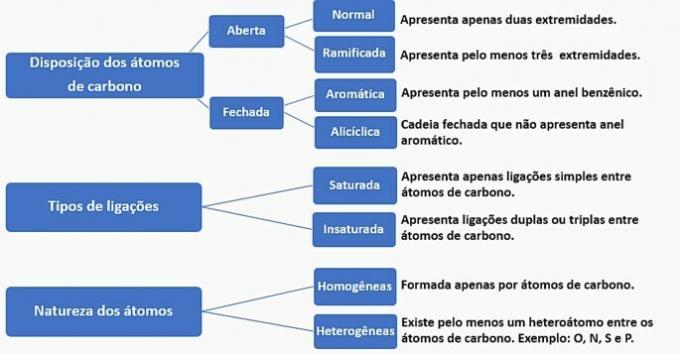
I henhold til denne informasjonen har vi:
a) FEIL. Kjeden er klassifisert som normal, mettet, homogen og alisyklisk.
b) FEIL. Kjeden er klassifisert som normal, umettet, homogen og åpen.
c) FEIL. Kjeden er klassifisert som forgrenet, umettet, homogen og åpen.
d) KORREKT. Kjeden er klassifisert som forgrenet, umettet, heterogen og alicyklisk, som
- Den har en gren: metylradikal;
- Har umettet: dobbeltbinding mellom karbon;
- Den har heteroatom: oksygen bundet til to karbonatomer;
- Den presenterer en lukket kjede: karbon koblet i en sirkel uten nærvær av en aromatisk ring.
e) FEIL. Kjeden er klassifisert som forgrenet, umettet, heterogen og åpen.
spørsmål 3
(Centec-BA) I strukturen vist nedenfor er de nummererte karbonene henholdsvis:
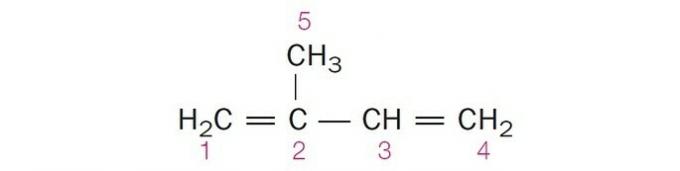
a) sp2, sp, sp2, sp2, sp3.
b) sp, sp3, sp2, sp, sp4.
c) sp2, sp2, sp2, sp2, sp3.
d) sp2, sp, sp, sp2, sp3.
e) sp3, sp, sp2, sp3, sp4.
Riktig alternativ: c) sp2, sp2, sp2, sp2, sp3.
Fordi det har 4 elektroner i valensskallet, er karbon tetravalent, det vil si at det har en tendens til å danne 4 kovalente bindinger. Disse obligasjonene kan være enkle, doble eller tredoble.
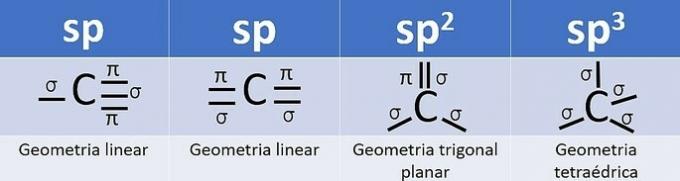
Antall hybridorbitaler er summen av karbonens sigma-bindinger (σ) siden bindingen hybridiserer ikke.
- sp: 2 sigma lenker
- sp2: 3 sigma lenker
- sp3: 4 sigma lenker
I henhold til denne informasjonen har vi:
a) FEIL. Carbon 2 har SP-hybridisering2, siden den har 3 σ-bindinger og en binding .
b) FEIL. Karbon har ingen SP-hybridisering4 og sp hybridisering oppstår når det er en trippelbinding eller to dobbeltbindinger mellom karbonatomer.
c) KORREKT. Summen av σ-bindingene på hvert karbon gir alternativ hybridisering.
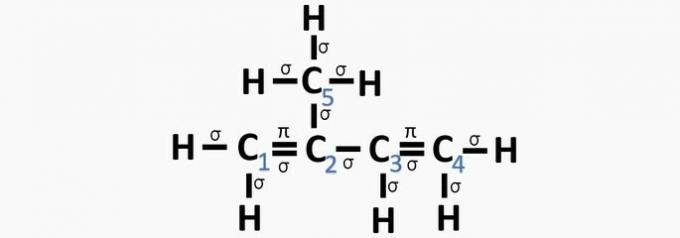
d) FEIL. Sp-hybridisering oppstår når det er en trippelbinding eller to dobbeltbindinger mellom karbonatomer.
e) FEIL. Karbon har ingen SP-hybridisering4 og sp hybridisering oppstår når det er en trippelbinding eller to dobbeltbindinger mellom karbonatomer.
spørsmål 4
(UFF) Det er en gassprøve dannet av en av følgende forbindelser: CH4; Ç2H4; Ç2H6; Ç3H6 eller C3H8. Hvis 22 g av denne prøven opptar et volum på 24,6 l ved et trykk på 0,5 atm og en temperatur på 27 ° C (gitt: R = 0,082 l. Atm. K–1.mol–1) konkluderes det med at det er gassen:
a) etan.
b) metan.
c) propan.
d) propen.
e) eten.
Riktig alternativ: c) propan.
1. trinn: konverter temperaturenheten fra Celsius til Kelvin.
Andre trinn: beregne antall mol av forbindelsen ved hjelp av den generelle gassligningen.
Tredje trinn: beregne molarmassen til forbindelsen.
Fjerde trinn: Finn hydrokarbonet som har en molarmasse på 44 g / mol.
Metan
Ethene
Etan
propylen
Propan
Dermed konkluderes det med at gassen som tilsvarer informasjonen i uttalelsen er propan.
spørsmål 5
(ITA) Vurder følgende stoffer:
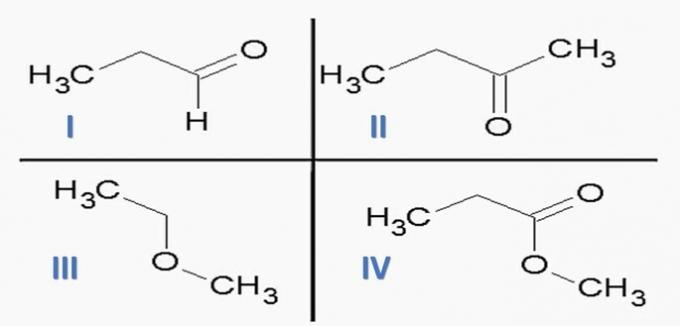
og følgende kjemiske funksjoner:
De. karboksylsyre;
B. alkohol;
ç. aldehyd;
d. keton;
og. ester;
f. eter.
Alternativet som KORRIG forbinder stoffer med kjemiske funksjoner er:
a) Id; IIc; IIIe; IVf.
b) Ic; IId; IIIe; Mva
c) Ic; IId; IIIf; IVe.
d) Id; IIc; IIIf; IVe.
e) Ia; IIc; IIIe; IVd.
Riktig alternativ: c) Ic; IId; IIIf; IVe.
Organiske funksjoner bestemmes av strukturer og grupperer organiske forbindelser med lignende egenskaper.
De kjemiske funksjonene i alternativene er:
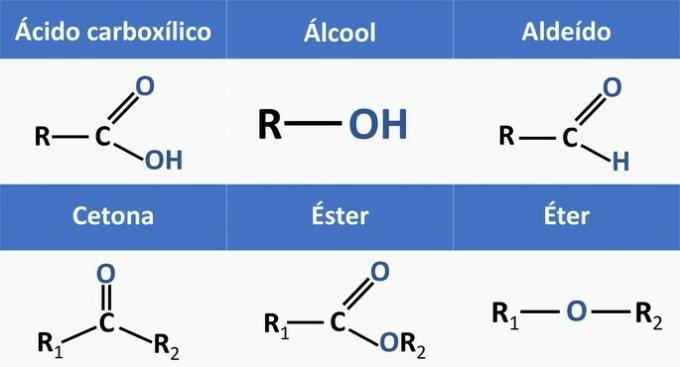
Når vi analyserer strukturene ovenfor og forbindelsene som er tilstede i uttalelsen, har vi:
a) FEIL. Orgelfunksjonene er korrekte, men sekvensen er feil.
b) FEIL. Det er ingen karboksylsyre blant forbindelsene.
c) KORREKT. Funksjonelle grupper tilstede i forbindelsene representerer følgende kjemiske funksjoner.

d) FEIL. Jeg er aldehyd og II er keton.
e) FEIL. Det er ingen karboksylsyre blant forbindelsene.
Lær mer på: Organiske funksjoner.
Enem spørsmål
Spørsmål 1
(Enem / 2014) En metode for å bestemme etanolinnholdet i bensin består i å blande kjente volumer vann og bensin i en bestemt flaske. Etter å ha ristet kolben og ventet på en periode, måles volumene av de to blandbare fasene som oppnås: den ene organiske og den andre vandig. Etanol, en gang blandbart med bensin, er nå blandbart med vann.
For å forklare oppførselen til etanol før og etter tilsetning av vann, er det nødvendig å vite
a) væsketettheten.
b) størrelsen på molekylene.
c) kokepunktet for væsker.
d) atomene som er tilstede i molekylene.
e) typen interaksjon mellom molekylene.
Riktig alternativ: e) typen interaksjon mellom molekylene.
Intermolekylære krefter påvirker løseligheten av organiske forbindelser. Stoffer har en tendens til å oppløses med hverandre når de har samme intermolekylære kraft.
Se i tabellen nedenfor noen eksempler på organiske funksjoner og typen interaksjon mellom molekyler.
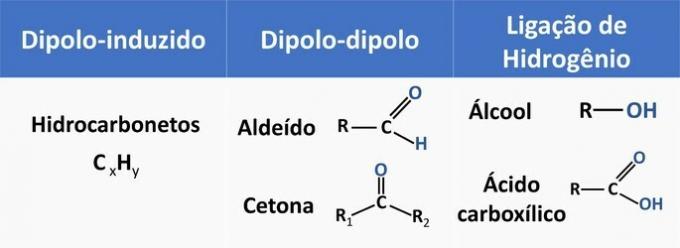
Etanol regnes som et polært løsningsmiddel, da det har en polær gruppe (—OH) i sin struktur. Imidlertid er karbonkjeden, som er ikke-polær (CH), i stand til å samhandle med ikke-polære løsningsmidler. Derfor oppløses etanol både i vann og i bensin.
I henhold til denne informasjonen har vi:
a) FEIL. Tetthet knytter kroppens masse til det okkuperte volumet.
b) FEIL. Størrelsen på molekylene påvirker forbindelsenes polaritet: jo større karbonkjede, jo mer ikke-polær blir stoffet.
c) FEIL. Kokepunktet er nyttig for å separere molekyler: destillasjon skiller forbindelser med forskjellige kokepunkter. Jo lavere kokepunkt, desto lettere fordampes molekylet.
d) FEIL. Et aldehyd har karbon, hydrogen og oksygen i strukturen. Denne forbindelsen utfører dipol-dipol-interaksjoner, mens en alkohol med de samme elementene er i stand til å danne hydrogenbindinger.
e) KORREKT. Samspillet mellom etanol og vann (hydrogenbinding) er mer intens enn med bensin (diploindusert).
spørsmål 2
(Enem / 2013) Molekylene til nanoputians de ligner menneskeskikkelser og ble skapt for å stimulere unges interesse for å forstå språket uttrykt i strukturformler, mye brukt i organisk kjemi. Et eksempel er NanoKid, representert i figuren:
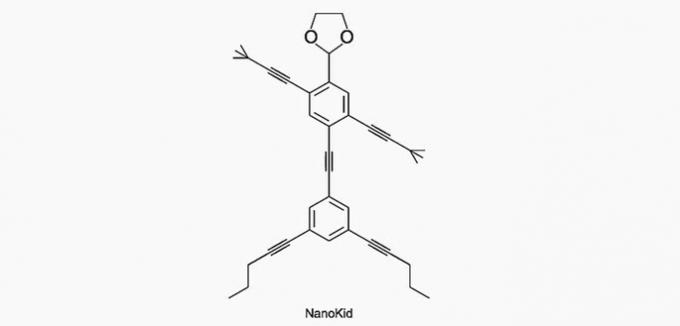
Hvor i NanoKids kropp er det kvartært karbon?
a) Hender.
b) Hode.
c) Bryst.
d) Mage.
e) Føtter.
Riktig alternativ: a) Hender.
Kull er klassifisert som følger:
- Primær: binder seg til et karbon;
- Sekundær: binder seg til to karbonatomer;
- Tertiær: binder seg til tre karbonatomer;
- Kvartær: binder seg til fire karbonatomer.
Se eksemplene nedenfor.

I henhold til denne informasjonen har vi:
a) KORREKT. Karbonet i hånden er bundet til fire andre karbonatomer, så det er kvaternært.
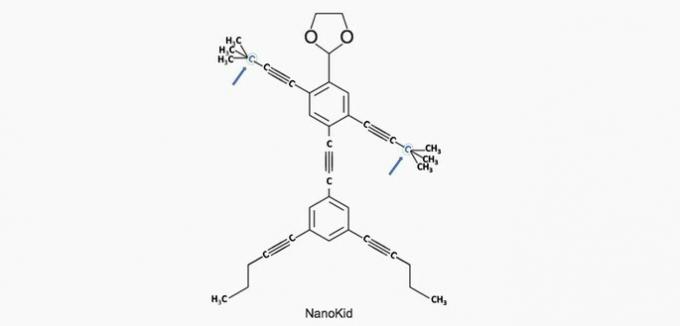
b) FEIL. Hodet består av primære karbonatomer.
c) FEIL. Brystet består av sekundære og tertiære karbonatomer.
d) FEIL. Underlivet består av sekundære karbonatomer.
e) FEIL. Føttene er laget av primære karbonatomer.
spørsmål 3
(Enem / 2014) Noen polymere materialer kan ikke brukes til produksjon av visse typer gjenstander, verken for begrensninger av mekaniske egenskaper, enten på grunn av den lette nedbrytningen, og genererer uønskede biprodukter for det applikasjon. Derfor blir inspeksjon viktig for å bestemme arten av polymeren som brukes ved fremstilling av gjenstanden. En av de mulige metodene er basert på nedbrytningen av polymeren for å generere monomerer som ga opphav til den.
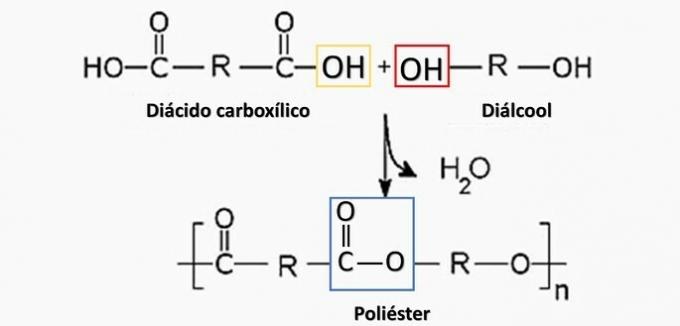
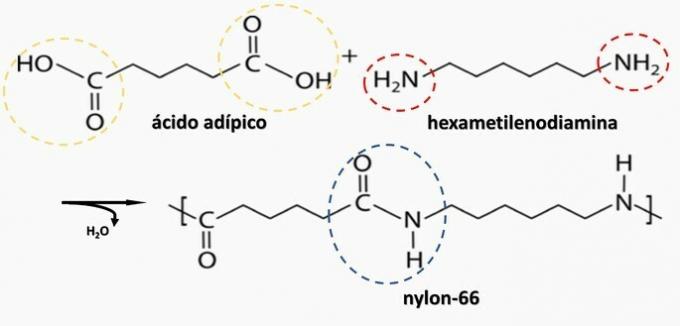
Kontrollert spaltning av en gjenstand generert diamin H2N (CH2)6NH2 og HO-syren2C (CH2)4CO2H. Derfor ble artefakten laget av
a) polyester.
b) polyamid.
c) polyetylen.
d) polyakrylat.
e) polypropylen.
Riktig alternativ: b) polyamid.
a) FEIL. Polyester dannes i reaksjonen mellom en dikarboksylsyre (—COOH) og en dialkohol (—OH).
b) KORREKT. Polyamid dannes ved polymerisering av en dikarboksylsyre (—COOH) med en diamin (—NH2).
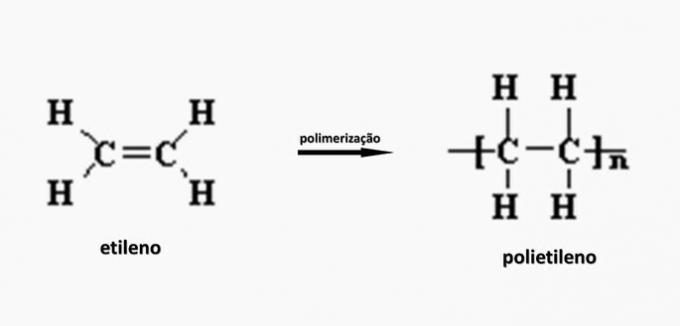
c) FEIL. Polyetylen dannes ved polymerisering av etylenmonomer.
d) FEIL. Polyakrylat dannes av et salt avledet fra karboksylsyre.
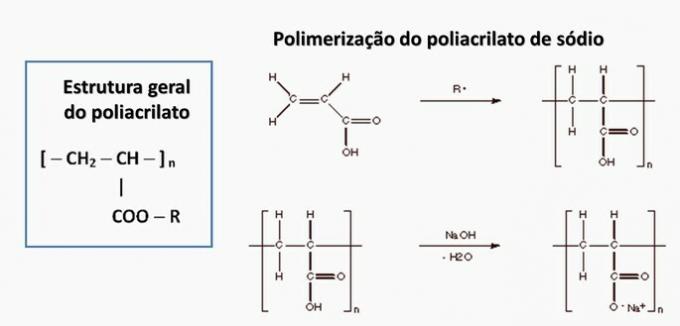
e) FEIL. Polypropylen dannes ved polymerisering av propylenmonomer.
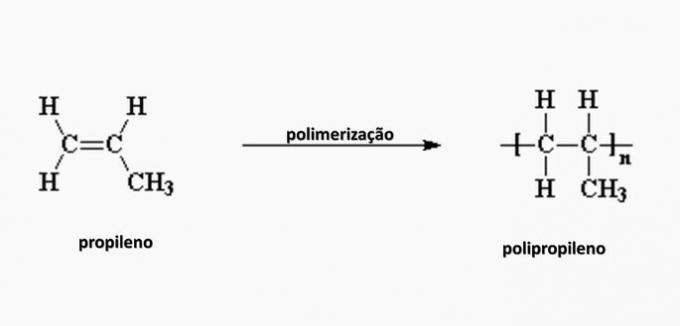
spørsmål 4
(Enem / 2008) Kina har forpliktet seg til å skadesfri Russland for utslipp av benzen fra en industri Kinesiske petrokjemikalier i Songhua-elven, en biflod til Amur-elven, som utgjør en del av grensen mellom de to land. Presidenten for Federal Water Resources Agency of Russia forsikret at benzen ikke vil nå rørledningene til drikkevann, men ba befolkningen koke rennende vann og unngå fiske i Amur-elven og dens bifloder. Lokale myndigheter lagrer hundrevis av tonn kull, da mineralet betraktes som en effektiv benzenabsorber. Internett: (med tilpasninger). Tatt i betraktning tiltakene som er vedtatt for å minimere miljø- og befolkningsskader, er det riktig å si det
a) kull reagerer med benzen når det plasseres i vann og eliminerer det.
b) benzen er mer flyktig enn vann, og derfor må den kokes.
c) orienteringen for å unngå fiske skyldes behovet for å bevare fisk.
d) benzen vil ikke forurense drikkevannsrør, da det naturlig dekanteres i bunnen av elven.
e) forurensningen forårsaket av den kinesiske industrins benzenutslipp vil være begrenset til Songhua-elven.
Riktig alternativ: b) benzen er mer flyktig enn vann, og det er derfor nødvendig at den kokes.
a) FEIL. Kull inneholder i sin struktur flere porer og brukes som et adsorbent, da det er i stand til å samhandle med forurensninger og beholde dem på overflaten, men ikke eliminere dem.
b) KORREKT. Jo større flyktighet et stoff har, desto lettere forandres det til en gassform. Mens vannets kokepunkt er 100 ° C, er det for benzen 80,1 ° C. Dette er fordi vann er en polær forbindelse og benzen er en ikke-polær forbindelse.
Type interaksjoner molekyler lager er forskjellige og påvirker også kokepunktet til stoffer. Vannmolekylet er i stand til å lage hydrogenbindinger, en type interaksjon som er mye sterkere enn den som benzen, med den induserte dipolen, er i stand til å lage.
c) FEIL. I en næringskjede blir det ene vesenets mat i henhold til samspillet mellom arter på et sted. Når et giftig stoff slippes ut i et miljø, er det gradvis opphopning og fisk forurenset, når det inntas av mennesker, kan ta benzen med seg og forårsake DNA-mutasjoner og til og med til og med kreft.
d) FEIL. Benzen har lavere tetthet enn vann. Dermed er trenden at selv under vann fortsetter den å spre seg.
e) FEIL. Sesongmessige endringer kan øke problemet ytterligere, da lave temperaturer reduserer den biologiske nedbrytningskapasiteten til kjemikalier ved påvirkning fra solen eller bakteriene.
spørsmål 5
(Enem / 2019) Hydrokarboner er organiske molekyler med en rekke industrielle applikasjoner. For eksempel er de til stede i store mengder i de forskjellige petroleumsfraksjonene og skilles vanligvis ved fraksjonell destillasjon basert på koketemperaturen. Tabellen viser hovedfraksjonene oppnådd ved destillasjon av olje i forskjellige temperaturområder.
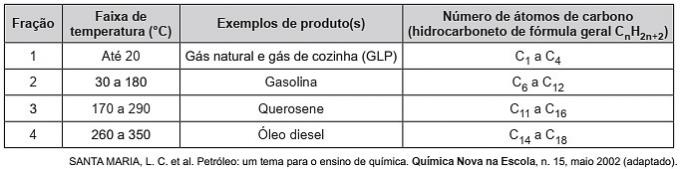
I fraksjon 4 skjer separasjonen av forbindelser ved høyere temperaturer pga
a) dens tetthet er større.
b) antall grener er større.
c) dets løselighet i olje er større.
d) intermolekylære krefter er mer intense.
e) karbonkjeden er vanskeligere å bryte.
Riktig alternativ: d) de intermolekylære kreftene er mer intense.
Hydrokarboner samhandler med indusert dipol, og denne typen intermolekylær kraft forsterkes med økningen av karbonkjeden.
Derfor har de tyngre petroleumsfraksjonene en høyere koketemperatur, ettersom kjedene samhandler sterkere av en indusert dipol.
For flere øvelser, med kommentert oppløsning, se også:
- Øvelser på hydrokarboner
- Øvelser på organiske funksjoner
- Kjemispørsmål i fiende
