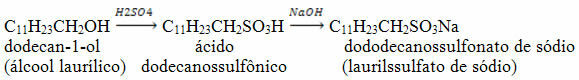Uorganiske funksjoner er grupper av uorganiske forbindelser som har lignende egenskaper.
En grunnleggende klassifisering i forhold til kjemiske forbindelser er: organiske forbindelser er de som inneholder karbonatomer, mens organiske forbindelser inneholder karbonatomer. uorganiske forbindelser de dannes av de andre kjemiske elementene.
Det er unntak som CO, CO2 og på2CO3, som til tross for å ha karbon i strukturformelen, har egenskaper av uorganiske stoffer.
De fire viktigste uorganiske funksjonene er: syrer, baser, salter og oksider.
Disse fire hovedfunksjonene ble definert av Arrhenius, en kjemiker som identifiserte ioner i syrer, baser og salter.
Syrer
Syrer de er kovalente forbindelser, det vil si at de deler elektroner i sine bindinger. De har evnen til å ionisere i vann og danne ladninger, og frigjør H+ som eneste kation.
Klassifisering av syrer
Syrer kan klassifiseres i henhold til mengden hydrogen som frigjøres i en vandig løsning og ioniseres, og reagerer med vann for å danne hydroniumionet.
| Antall ioniserbare hydrogener |
|---|
|
Monosyrer: de har bare ett ioniserbart hydrogen. Eksempler: HNO3, HCl og HCN |
|
syrer: har to ioniserbare hydrogener. Eksempler: H2KUN4, H2S og H2MnO4 |
|
Triacider: har tre ioniserbare hydrogener. Eksempler: H3STØV4 og H3BO3 |
|
tetracider: har fire ioniserbare hydrogener. Eksempler: H4P7O7 |
Styrken til en syre måles ved graden av ionisering. Jo høyere verdi av sterkere er syren fordi:
| grad av ionisering |
|---|
|
sterk: har en ioniseringsgrad større enn 50%. |
|
moderat: har en grad av ionisering mellom 5% og 50%. |
|
svak: har en grad av ionisering under 5%. |
Syrer kan eller ikke inneholder elementet oksygen i sin struktur, og dermed:
| tilstedeværelse av oksygen |
|---|
|
Hidracids: har ikke oksygenatomer. Eksempler: HCl, HBr og HCN. |
|
oksysyrer: Elementet oksygen er tilstede i syrestrukturen. Eksempler: HClO, H2CO3 og HNO3. |
Syrenomenklatur
Den generelle formelen for en syre kan beskrives som HxDE, hvor A representerer anionet som utgjør syren og den genererte nomenklaturen kan være:
| avslutning av anioner | Syreavslutning |
|---|---|
|
etho Eksempel: Klorid (Cl-) |
vannkraft Eksempel: saltsyre (HCl) |
|
handling Eksempel: klorat |
jeg Eksempel: klorsyre (HClO3) |
|
veldig Eksempel: nitritt |
bein Eksempel: salpetersyre (HNO2) |
Kjennetegn ved syrer
De viktigste egenskapene til syrer er:
- De smaker surt.
- De bærer elektrisk strøm, ettersom de er elektrolytiske løsninger.
- De danner hydrogengass når de reagerer med metaller som magnesium og sink.
- Dann karbondioksid når du reagerer med kalsiumkarbonat.
- De endrer syrebasisindikatorene til en bestemt farge (blå lakmuspapir blir rød).
Hovedsyrer
Eksempler: saltsyre (HCl), svovelsyre (H2KUN4eddiksyre (CH3COOH), karbonsyre (H2CO3) og salpetersyre (HNO3).

Selv om eddiksyre er en syre fra organisk kjemi, er det viktig å kjenne strukturen på grunn av dens betydning.
Baser
Baser er ioniske forbindelser dannet av kationer, for det meste metaller, som dissosierer seg i vann som frigjør hydroksidanionet (OH-).
Baseklassifisering
Baser kan klassifiseres i henhold til antall hydroksyler som frigjøres i oppløsningen.
| Antall hydroksyler |
|---|
|
Monobaser: de har bare en hydroksyl. Eksempler: NaOH, KOH og NH4Åh |
|
Dibaser: har to hydroksyler. Eksempler: Ca (OH)2, Fe (OH)2 og Mg (OH)2 |
|
Tribaser: har tre hydroksyler. Eksempler: Al (OH)3 og Fe (OH)3 |
|
tetrabaser: har fire hydroksyler. Eksempler: Sn (OH)4 og Pb (OH)4 |
Baser er generelt ioniske stoffer, og styrken til en base måles ved graden av dissosiasjon.
Jo høyere verdi av sterkere er basen fordi:
| dissosiasjon grad |
|---|
|
sterk: de har en grad av dissosiasjon praktisk talt 100%. Eksempler:
|
|
svak: ha en grad av dissosiasjon under 5%. Eksempel: NH4OH og Zn (OH)2. |
| Løselighet i vann |
|---|
|
Løselig: baser av alkalimetall og ammonium. Eksempler: Ca (OH)2, Ba (OH)2 og NH4Åh. |
|
Litt løselig: alkaliske jordartsmetallbaser. Eksempler: Ca (OH)2 og Ba (OH)2. |
|
praktisk talt uløselig: andre baser. Eksempler: AgOH og Al (OH)3. |
Basenomenklatur
Den generelle formelen for en base kan beskrives som , hvor B representerer den positive radikale som utgjør basen og y er ladningen som bestemmer antall hydroksyler.
Nomenklaturen for baser med fast belastning er gitt av:
| Understell med fast belastning | ||
|---|---|---|
alkalimetaller |
litiumhydroksid |
LiOH |
| Alkaliske jordmetaller | magnesiumhydroksid |
Mg (OH)2 |
Sølv |
sølvhydroksid |
AgOH |
| Sink | sinkhydroksid | Zn (OH)2 |
| Aluminium | aluminiumhydroksyd | Al (OH)3 |
Når basen har variabel belastning, kan nomenklaturen være på to måter:
| Underlag med variabel belastning | |||
|---|---|---|---|
| Kobber | Ass+ | kobberhydroksyd I | CuOH |
| kobberhydroksid | |||
| Ass2+ | kobberhydroksid II | Cu (OH)2 | |
| kobberhydroksid | |||
| Jern | Tro2+ | Jernhydroksid II | Fe (OH)2 |
| jernholdig hydroksid | |||
| Tro3+ | Jernhydroksid III | Fe (OH)3 | |
| jernhydroksid |
Kjennetegn ved basene
- De fleste baser er uoppløselige i vann.
- Led elektrisk strøm i vandig løsning.
- De er glatte.
- De reagerer med syre for å danne salt og vann som produkter.
- De endrer syrebasisindikatorene til en bestemt farge (rød lakmuspapir blir blå).
Hovedbaser
Baser brukes mye i rengjøringsprodukter og også i kjemiske industriprosesser.
Eksempler: natriumhydroksyd (NaOH), magnesiumhydroksid (Mg (OH))2), ammoniumhydroksyd (NH4OH), aluminiumhydroksid (Al (OH)3) og kalsiumhydroksid (Ca (OH)2).

salter
salter er ioniske forbindelser som har minst ett annet kation enn H+ og et annet anion enn OH-.
Et salt kan oppnås i en nøytraliseringsreaksjon, som er reaksjonen mellom en syre og en base.
Reaksjonen av saltsyre med natriumhydroksid gir natriumklorid og vann.
Saltet som dannes består av syreanionet (Cl-) og ved basiskation (Na+).
Klassifisering av salter
Nedenfor har vi de viktigste familiene av salter som kan klassifiseres i henhold til vannløselighet og pH-endring av løsningen som følger:
| Vannløselighet av de vanligste saltene | |||
|---|---|---|---|
| Løselig | Nitrater | Unntak: Sølvacetat. |
|
| Klorater | |||
Acetater |
|||
| Klorider | Unntak: |
||
| Bromider | |||
| Jodider | |||
| Sulfater |
Unntak: |
||
| Uoppløselig | Sulfider |
Unntak: alkalisk jord og ammonium. |
|
| Karbonater | Unntak: De av alkalimetaller og ammonium. |
||
| Fosfater |
| pH | |
|---|---|
| nøytrale salter |
Når de er oppløst i vann, endrer de ikke pH. Eksempel: NaCl. |
| syresalter |
Når de er oppløst i vann, gjør de løsningen til pH mindre enn 7. Eksempel: NH4Cl. |
| basissalter |
Når de er oppløst i vann, gjør de løsningen pH større enn 7. Eksempel: CH3COONa. |
I tillegg til saltfamiliene vi så tidligere, er det andre typer salter, som vist i tabellen nedenfor.
| Andre typer salter | |
|---|---|
| hydrogensalter | Eksempel: NaHCO3 |
| Hydroksysalter | Eksempel: Al (OH)2Cl |
| doble salter | Eksempel: KNaSO4 |
| hydratiserte salter | Eksempel: CuSO4. 5 timer2O |
| komplekse salter | Eksempel: [Cu (NH3)4]KUN4 |
Nomenklatur for salter
Generelt følger nomenklaturen til et salt følgende rekkefølge:
| anionnavn | kationens navn | navnet på saltet |
|---|---|---|
|
Cl- Klorid |
Tro3+ Jern III |
FeCl3 Jernklorid III |
|
Sulfat |
På+ Natrium |
På2KUN4 Natriumsulfat |
|
Nitritt |
K+ Kalium |
KNO2 Kaliumnitrit |
|
br- Bromid |
Her2+ Kalsium |
CaBr2 kalsiumbromid |
Karakteristikk av salter
- De er ioniske forbindelser.
- De er faste og krystallinske.
- Lider av å koke ved høye temperaturer.
- Led elektrisk strøm i løsningen.
- De smaker salt.
Hovedsalter
Eksempler: kaliumnitrat (KNO3), natriumhypokloritt (NaClO), natriumfluorid (NaF), natriumkarbonat (Na2CO3) og kalsiumsulfat (CaSO4).

Oksider
Oksider er binære forbindelser (ioniske eller molekylære) som har to elementer. De har oksygen i sammensetningen, som er deres mest elektronegative element.
Den generelle formelen for et oksid er hvor C er kationen og dens ladning y blir en indeks i oksidet som danner forbindelsen:
Klassifisering av oksider
| I følge kjemiske bindinger | |
|---|---|
| Jonisk |
Kombinasjon av oksygen med metaller. Eksempel: ZnO. |
| Molekylær |
Kombinasjon av oksygen med ikke-metalliske elementer. Eksempel: OS2. |
| I henhold til egenskaper | |
|---|---|
| Grunnleggende |
I vandig løsning endrer de pH til mer enn 7. Eksempel: Jeg leste2O (og andre jord- og jordalkalimetaller). |
| Syrer |
I vandig løsning reagerer de med vann og danner syrer. Eksempler: CO2, KUN3 og nei2. |
| Nøytrale |
Noen oksider som ikke reagerer med vann. Eksempel: CO. |
| Peroksider |
I vandig løsning reagerer de med vann eller fortynnede syrer og danner hydrogenperoksid H2O2. Eksempel: Na2O2. |
| Amfotere |
De kan oppføre seg som syrer eller baser. Eksempel: ZnO. |
Nomenklatur for oksider
Generelt følger nomenklaturen til et oksid følgende rekkefølge:
| Navn etter type oksid | |
|---|---|
| ioniske oksider |
Eksempler på fastladede oksider: CaO - kalsiumoksid Al2O3 - aluminiumoksid |
|
Eksempler på oksider med variabel ladning: FeO - Jernoksid II Tro2O3 - Jernoksid III | |
| molekylære oksider |
Eksempler: CO - karbonmonoksid N2O5 - Dinitrogen pentoxide |
Oksydegenskaper
- De er binære stoffer.
- De dannes ved binding av oksygen med andre grunnstoffer, unntatt fluor.
- Metalloksider danner salt og vann når de reagerer med syrer.
- Ikke-metalliske oksider danner salt og vann når de reagerer med baser.
Hovedoksider
Eksempler: kalsiumoksid (CaO), manganoksid (MnO2), tinnoksid (SnO2), jernoksid III (Fe2O3) og aluminiumoksid (Al2CO3).

Inngangseksamen Øvelser
1. (UEMA / 2015) NEI2og operativsystemet2 er gasser som forårsaker luftforurensning som blant skadene forårsaker dannelse av av surt regn når disse gassene reagerer med vannpartikler i skyer og produserer HNO3 og H2KUN4.
Disse forbindelsene, når de bæres av atmosfærisk nedbør, genererer forstyrrelser, som forurensning av drikkevann, korrosjon av kjøretøyer, historiske monumenter, etc.
De uorganiske forbindelsene nevnt i teksten tilsvarer henholdsvis funksjonene:
a) salter og oksider
b) baser og salter
c) syrer og baser
d) baser og oksider
e) oksider og syrer
Riktig alternativ: e) oksider og syrer.

Oksider er forbindelser dannet av oksygen og andre grunnstoffer, unntatt fluor.
Syrer, når de kommer i kontakt med vann, gjennomgår ionisering og produserer hydroniumionet. For de aktuelle syrene har vi følgende reaksjoner:
HNO3 det er monosyre fordi det bare har ett ioniserbart hydrogen. H2KUN4 det er en syre fordi den har to ioniserbare hydrogener.
De andre uorganiske funksjonene i spørsmålene tilsvarer:
Baser: hydroksylioner (OH-) ionisk bundet med metallkationer.
Salter: produkt av nøytraliseringsreaksjonen mellom en syre og en base.
Lære mer omkjemiske funksjoner.
2. (UNEMAT / 2012) Vi bruker forskjellige kjemiske produkter i vårt daglige liv, som magnesiummelk, eddik, kalkstein og kaustisk brus.
Det er riktig å si at disse nevnte stoffene tilhører henholdsvis de kjemiske funksjonene:
a) syre, base, salt og base
b) base, salt, syre og base
c) base, syre, salt og base
d) syre, base, base og salt
e) salt, syre, salt og base
Riktig alternativ: c) base, syre, salt og base.
Magnesiummelk, kalkstein og kaustisk brus er eksempler på forbindelser som inneholder uorganiske funksjoner i strukturene.
Eddik er en organisk forbindelse dannet av en svak karboksylsyre.
I tabellen nedenfor kan vi observere strukturene til hver enkelt av dem og de kjemiske funksjonene som kjennetegner dem.
| Produkt | Magnesiummelk | Eddik | Kalkstein | Kaustisk soda |
|---|---|---|---|---|
| Kjemisk kompost | magnesiumhydroksid | Eddiksyre | Kalsiumkarbonat | Natriumhydroksid |
| Formel | ||||
| kjemisk funksjon | Utgangspunkt | karboksylsyre | salt | Utgangspunkt |
Magnesiummelk er en suspensjon av magnesiumhydroksid som brukes til å behandle magesyre, da den reagerer med saltsyre fra magesaft.
Eddik er et mye brukt krydder hovedsakelig i matlaging på grunn av aroma og smak.
Kalkstein er en sedimentær bergart, hvis hovedmalm er kalsitt, som inneholder store mengder kalsiumkarbonat.
Kaustisk brus er handelsnavnet for natriumhydroksid, en sterk base som brukes i mange industrielle prosesser og husholdningsbruk for å rense rør på grunn av opphopning av oljer og fett.
3. (UDESC / 2008) Når det gjelder saltsyre, kan det sies at:
a) når den er i vandig løsning, tillater den passering av elektrisk strøm
b) er en syre
c) er en svak syre
d) har en lav grad av ionisering
e) er et ionisk stoff
Riktig alternativ: a) når det er i vandig løsning, tillater det strøm av elektrisk strøm.
Saltsyre er en monosyre, da den bare har ett ioniserbart hydrogen.
Det er en molekylær forbindelse, med høy grad av ionisering, og derfor er den en sterk syre som, når den kommer i kontrakt med vann, bryter molekylet sitt i ioner som følger:
Som Arrhenius observerte i sine eksperimenter, beveger de positive ionene som dannes i ioniseringen seg mot den negative polen, mens de negative ionene beveger seg mot den positive polen.
På denne måten strømmer elektrisk strøm inn i løsningen.
For flere problemer med kommentert oppløsning, se også: øvelser på uorganiske funksjoner.