Atomet er den grunnleggende enheten av materie og den minste fraksjonen som er i stand til å identifisere et kjemisk element, siden det har sin identitet. Begrepet atom er avledet fra gresk og betyr udelelig.
Den består av en kjerne, som inneholder nøytroner og protoner, og elektroner som omgir kjernen.
atomstruktur
Atomet er dannet av små partikler, også kalt subatomære partiklers: elektroner, protoner og nøytroner.
Det meste av atommassen er konsentrert i kjernen, en liten, tett region. Dens største volum finnes i elektrosfæren, et sted med tomme rom, mens elektroner kretser rundt kjernen.
elektroner
O elektron den har en negativ elektrisk ladning (-1) og nesten ingen masse, som sin verdi på 9,11 x 10-28 g og er omtrent 1840 ganger mindre enn kjernemassen. De er små partikler som spinner veldig raskt rundt atomkjernen.
Elektronene som finnes i de ytterste områdene av atomet er ansvarlige for dannelsen av kjemiske bindinger, som oppstår gjennom donasjon, mottakelse eller deling av elektroner.
protoner
O proton den har en positiv elektrisk ladning (+1) av samme absolutte verdi som ladningen på elektronene. På denne måten har en proton og et elektron en tendens til å tiltrekke hverandre elektrisk.
Gjennom protoner er det mulig å skille de kjemiske elementene, ettersom hvert atom i et element har et definert antall protoner i kjernen, som kalles atomnummer.
nøytroner
O nøytron den har ingen kostnad i det hele tatt, det vil si at den er elektrisk nøytral. Sammen med protonene danner den atomkjernen, som bærer hele massen av atomet (99,9%). Både proton og nøytron har omtrent massen 1,67 x 10-24 g. Denne verdien representerer en 1 μ atommasseenhet.
Nøytronen gir atomkjernen stabilitet, siden kjernekraften får den til å tiltrekkes av elektroner og protoner.
Bare hydrogenatomet har ikke nøytroner, og består bare av et elektron som dreier seg om et proton.
Sjekk tabellen nedenfor for a abstrakt med informasjon om subatomære partikler.
| Partikkel | Symbol |
Pasta (i enhet av atommasse) |
Lade (i enhet av elektrisk ladning - u.c.e) |
plassering |
|---|---|---|---|---|
| Proton | +1 | kjerne | ||
| Neutron | 0 | kjerne | ||
| Elektron | -1 | elektrosfæren |
Et atom i jordtilstand er elektrisk nøytralt, fordi antall protoner er lik antall elektroner og motsatte ladninger, positive og negative, avbryter hverandre.
For eksempel har natrium (Na) atomnummer 11, det vil si at kjernen har 11 protoner. Følgelig er det 11 elektroner i elektrosfæren til et atom av det elementet.
Les mer om Atomstruktur.
atomsammensetning
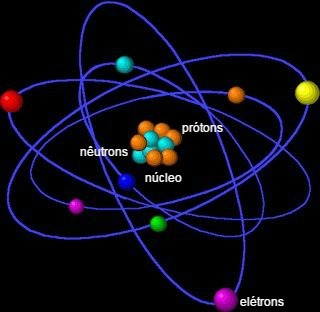
Som vi har sett, dannes atomet av en liten og tett sentral region som kalles kjernen, og rundt den er det en elektrosfæren, der elektronene befinner seg, som kan deles inn i elektroniske lag, energinivå og atomorbitaler.
elektroniske lag
atomet presenterer energinivåer, som tilsvarer syv lag rundt en kjerne og i dem er elektronene som kretser rundt den. Lagene kalles K, L, M, N, O, P og Q.
Hvert skall kan inneholde et visst antall elektroner, som vist i tabellen nedenfor.
| Energinivå | elektronisk lag | Maksimalt antall elektroner |
|---|---|---|
| 1º | K | 2 |
| 2º | L | 8 |
| 3º | M | 18 |
| 4º | N | 32 |
| 5º | O | 32 |
| 6º | P | 18 |
| 7º | Q | 8 |
For eksempel har heliumatomet (He) atomnummer 2 og har derfor 2 protoner i kjernen. Følgelig er det bare to elektroner i atomets elektrosfære, som befinner seg i atomets første og eneste elektroniske skall, K-skallet som tilsvarer det første energinivået.
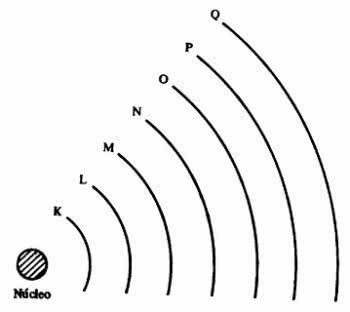
Undernivåer for energi
Energinivåer inneholder undernivåer, som er representert med s, p, d, f. Hvert delnivå har maksimalt antall elektroner, som er henholdsvis 2, 6, 10 og 14.

Med denne informasjonen er det mulig å elektronisk distribusjon av et atom og vet plasseringen av det ytterste og mest energiske elektronet.
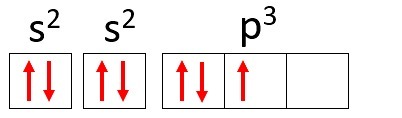
Eksempel: Nitrogen (N)
Atomnummer: 7
Elektronisk distribusjon: 1s2 2s2 2p3
Nitrogenatomet har to energinivåer, K og L, og dets 7 elektroner opptar s- og p-undernivåene.
K: s2 = 2 elektroner
L: s2 + s3 = 5 elektroner
Merk at L-skallet kan inneholde opptil 8 elektroner, men i nitrogenatomet er det bare 5 elektroner i det skallet.
atomorbitaler
Orbitaler karakteriserer regionen som mest sannsynlig vil finne et elektron i et energisk undernivå (s, p, d, f) i et elektronisk skall (K, L, M, N, O, P, Q).
- s undernivå: har 1 bane som rommer opptil 2 elektroner
- p undernivå: har 3 orbitaler som huser opptil 6 elektroner
- Undernivå d: har 5 orbitaler som huser opptil 10 elektroner
- Undernivå f: har 7 orbitaler som inneholder opptil 14 elektroner
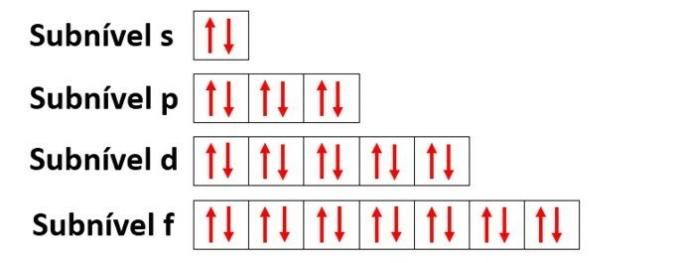
Ved å bruke nitrogen igjen som et eksempel og distribuere dets 7 elektroner i atomorbitaler, ville vi ha:
Atomtyper
Når vi observerer antall protoner, nøytroner og elektroner, kan vi sammenligne atomer og klassifisere dem i isotoper, isobarer og isotoner.
Et kjemisk element kan defineres som en gruppe atomer med samme antall protoner. Disse atomene kalles isotoper fordi de har samme atomnummer og forskjellige masser.
For eksempel er det i naturen tre isotoper av grunnstoffet hydrogen (H): protium , deuterium
og tritium
.
Atomer med forskjellige kjemiske elementer kan klassifiseres som isotoner når de har forskjellige atomnummer og masser, men det samme antall nøytroner.
Isobarer er atomer med forskjellige grunner, det vil si at de har et annet atomnummer, men det samme massetallet.
Les mer om isotoper, isobarer og isotoner.
Atom-modeller (atommodeller)
Den greske filosofen Aristoteles (384 a. Ç. - 322 a. C) prøvde å forklare sammensetningen av alle stoffer fra grunnstoffene jord, luft, ild og vann.
Democritus (546 a. C - 460 a. C), en gresk forsker og matematiker, formulerte ideen om at det var en grense for partikkelenes litenhet. Han sa at de ville bli så små at de ikke lenger kunne deles. Han kalte denne partikkelen et “atom”.
I det meste av 1800-tallet var det Dalton Atomic Model, Engelsk forsker, som foreslo atomteorien, som gikk langt utover tanken til de gamle.
Denne teorien sa at alle stoffer består av små udelelige partikler som kalles atomer, som vil være som biljardkuler. Etter hvert som studier av materiens struktur avanserte, ble det oppdaget at atomet dannes av andre små partikler som kalles subatomære partikler.
Med oppdagelsen av elektronet, thomson han formulerte modellen kjent som massepudding, som beskrev atomet som en positiv sfære med negativt ladede elektroner innebygd i overflaten.
Gjennom eksperimenter fysikeren Rutherford fant at atomet hadde hulrom og elektroner rundt en ekstremt liten, positiv kjerne. Dermed foreslo Rutherford at atommodellen skulle representere atomet.
Bohr forbedret modellen foreslått av Rutherford ved å finne at elektroner ikke roterer tilfeldig, men i spesifikke baner. Denne modellen ble kjent som planetarium.
Les også om:
- Atomic modeller
- Thomson Atomic Model
- Bohrs atommodell
- Rutherford Atomic Model
- Utvikling av atommodeller