Noen metaller finnes ikke frie i naturen og må oppnås gjennom laboratorieprosedyrer. En av de effektive og økonomiske metodene for å rense metaller er gjennom elektrolyse. Elektrolyse foregår i elektrolytiske celler, med to elektroder koblet til terminalene på en likestrømsgenerator.
Det er kjent at det i en elektrolytisk celle er en katode og en anode, se definisjonen for hver:
Katode: Det er den negative elektroden som tiltrekker seg kationer, og det er her kationreduksjonen oppstår.
anode: Den positive elektroden som tiltrekker anioner, og det er derfor anionen oksiderer.
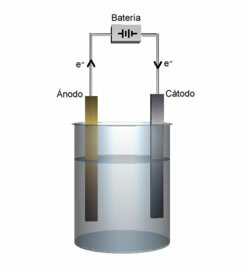
Anode- og katodedemonstrasjon.
Kobberrensing
Kobber som finnes i naturen har urenheter som sølv, jern, gull, sink. Gjennom elektrolyse er det mulig å isolere dette metallet og oppnå det i ren form, følg prosessen:
- Urent kobber fungerer som en anode, og en vandig løsning av kobbersulfat fungerer som en elektrolytt, som er inne i den elektrolytiske cellen. Cellens katode er kobber i seg selv i høy grad av renhet.
- Kobber overføres fra anoden til katoden mens urenhetene forblir i løsning. Kobber i ren tilstand akkumuleres ved katoden og kan dermed brukes.
Av Líria Alves
Uteksamen i kjemi
Brasil skolelag
Se mer!
Elektrolysereaksjoner
Elektrolyseprodukter
Elektrolyse - Fysisk-kjemisk - Kjemi - Brasilskolen
Kilde: Brasilskolen - https://brasilescola.uol.com.br/quimica/purificacao-metais-atraves-eletrolise.htm

