Vurder følgende kjemiske likevekt ved konstant temperatur:
3 timer2 (g) + N2 (g) NH 2 NH3 (g)
I følge Gay-Lussac er andelen volumer av gassformige deltakere i en reaksjon lik forholdet mellom de respektive støkiometriske koeffisientene. Enkelt sagt kan vi si at antall molekyler som er tilstede i reaktantene og produktene er lik koeffisientene i ligningen.
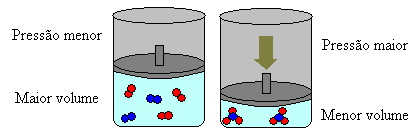
I tilfelle ovenfor har vi i reagensene 4 molekyler, og i produktene har vi 2 molekyler, noe som betyr at volumet på reagensene er større og at produktene er mindre.
Hvis vi øker trykket i dette systemet, vil balansen skifte mot mindre volum for å redusere dette trykket. I tilfelle av reaksjonen vi vurderer, vil forskyvningen være i direkte retning av produktdannelse (NH3 (g)).
Men hvis vi senker trykket, vil reaksjonen bevege seg mot det største volumet, som er motsatt retning, for dannelse av reaktanter (3H2 (g) + N2 (g)).
Ikke stopp nå... Det er mer etter annonseringen;)
Dette skjer i henhold til Le Chateliers prinsipp, som sier at enhver forstyrrelse (som å redusere eller øke trykket) forårsaket i et system i likevekt vil få det til å bevege seg i retningen som minimerer denne forstyrrelsen, og omstille seg til en ny balansere.
Kort fortalt kan vi si følgende når det gjelder påvirkning av trykkvariasjon på kjemisk likevekt:
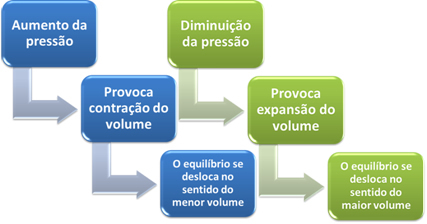
I tilfelle reaksjoner der volumet av reaktantene er lik volumet av produktene, endres ikke den kjemiske likevekten.
Av Jennifer Fogaça
Uteksamen i kjemi
Vil du referere til denne teksten i et skole- eller akademisk arbeid? Se:
FOGAÇA, Jennifer Rocha Vargas. "Variasjon av trykk og forskyvning av kjemisk balanse"; Brasilskolen. Tilgjengelig i: https://brasilescola.uol.com.br/quimica/variacao-pressao-deslocamento-equilibrio-quimico.htm. Tilgang 28. juni 2021.
Kjemi

Test din kunnskap og lær mer med denne listen over løste øvelser om kjemiske balanser. Gjennom dette materialet vil du være i stand til å bedre forstå hvordan man arbeider likevektskonstanter (Kp, Kc og Ki), likevektsskift, pH og pOH, samt likevekt i såkalte bufferløsninger.