Hess 'lov tillater oss å beregne entalpievariasjonen, som er mengden energi som er tilstede i stoffer etter å ha gjennomgått kjemiske reaksjoner. Dette er fordi det ikke er mulig å måle selve entalpien, men dens variasjon.
Hess 'lov ligger til grunn for studiet av termokjemi.
Denne loven ble eksperimentelt utviklet av Germain Henry Hess, som etablerte:
Endalpiendringen (ΔH) i en kjemisk reaksjon avhenger bare av reaksjonens innledende og endelige tilstand, uavhengig av antall reaksjoner.
Hvordan kan Hess 'lov beregnes?
Endalpiendringen kan beregnes ved å trekke den første entalpien (før reaksjonen) fra den endelige entalpien (etter reaksjonen):
ΔH = Hf - HJeg
En annen måte å beregne den på er gjennom summen av entalpiene i hver av de mellomliggende reaksjonene. Uavhengig av antall reaksjoner og type.
ΔH = ΔH1 + ΔH2
Siden denne beregningen bare tar hensyn til de innledende og endelige verdiene, konkluderes det med at mellomenergien ikke påvirker resultatet av dens variasjon.
Dette er et spesielt tilfelle av Prinsipp for energibesparelse, a Første lov om termodynamikk.
Du bør også vite at Hess 'lov kan beregnes som en matematisk ligning. For å gjøre dette kan du utføre følgende handlinger:
- Omvend den kjemiske reaksjonen, i hvilket tilfelle også ΔH-tegnet må reverseres;
- Multipliser ligningen, verdien av ΔH må også multipliseres;
- Del ligningen, verdien av ΔH må også deles.
vite mer om entalpi.
Enthalpediagram
Hess 'lov kan også visualiseres gjennom energidiagrammer:
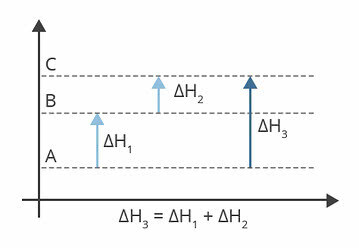
Diagrammet over viser entalpinivåene. I dette tilfellet er reaksjonene som er endotermiske, det vil si at det er energiabsorpsjon.
ΔH1 er entalpiendringen som skjer fra A til B. Anta at det er 122 kj.
ΔH2 er entalpiendringen som skjer fra B til C. Anta at det er 224 kj.
ΔH3 er entalpiendringen som skjer fra A til C.
Så det betyr noe for oss å vite verdien av ΔH3, da det tilsvarer endringen i entalpi av reaksjonen fra A til C.
Vi kan finne verdien av ΔH3, fra summen av entalpi i hver av reaksjonene:
ΔH3 = ΔH1 + ΔH2
ΔH3 = 122 kj + 224 kj
ΔH3 = 346 kj
Eller ΔH = Hf - HJeg
ΔH = 346 kj - 122 kj
ΔH = 224 kj
Inngangseksamen: Løst trinnvis
1. (Fuvest-SP) Basert på entalpievariasjoner assosiert med følgende reaksjoner:
N2 (g) + 2 O2 (g) → 2 NO2 (g) ∆H1 = +67,6 kJ
N2 (g) + 2 O2 (g) → N2O4 (g) ∆H2 = +9,6 kJ
Det kan forutsies at entalpi-variasjonen assosiert med NO-dimeriseringsreaksjonen2 vil være lik:
2 NO2 (g) → 1 N2O4 (g)
a) -58,0 kJ b) +58,0 kJ c) -77,2 kJ d) +77,2 kJ e) +648 kJ
Vedtak:
Trinn 1: Inverter den første ligningen. Det er fordi NEI2 (g) den må flytte til reaktantsiden, ifølge den globale ligningen. Husk at når du snur reaksjonen, reverserer ∆H1 også tegnet og endrer det til negativt.
Den andre ligningen er bevart.
2 NEI2 (g) → N2 (g) + 2 O2 (g) ∆H1 = - 67,6 kJ
N2 (g) + 2 O2 (g) → N2O4 (g) ∆H2 = +9,6 kJ
Trinn 2: Merk at N2 (g) vises i produkter og reagenser, og det samme skjer med 2 mol O2 (g).
2 NEI2 (g) → N2 (g)+ 2 O2 (g)∆H1 = - 67,6 kJ
N2 (g) + 2 O2 (g) → N2O4 (g) ∆H2 = +9,6 kJ
Dermed kan de bli kansellert, noe som resulterer i følgende ligning:
2 NEI2 (g) → N2O4 (g).
Trinn 3: Du kan se at vi har kommet til den globale ligningen. Nå må vi legge til ligningene.
∆H = ∆H1 + ∆H2
∆H = - 67,6 kJ + 9,6 kJ
∆H = -58 kJ ⇒ Alternativ A
Fra den negative verdien av ∆H vet vi også at det er en eksoterm reaksjon, med frigjøring av varme.
Lær mer, les også:
- termokjemi
- Øvelser på termokjemi
- Endotermiske og eksoterme reaksjoner
- Andre lov om termodynamikk
Øvelser
1. (UDESC-2012) Metangass kan brukes som drivstoff, som vist i ligning 1:
CH4 (g) + 2O2 (g) → CO2 (g) + 2H2O(g)
Ved å bruke de termokjemiske ligningene nedenfor, som du anser nødvendig, og begrepene i Hess 'lov, får du entalpiverdien til ligning 1.
Ç(s) + H2O(g) → CO(g) + H2 (g) ΔH = 131,3 kJ mol-1
CO(g) + ½2 (g) → CO2 (g) ΔH = - 283,0 kJ mol-1
H2 (g) + ½2 (g) → H2O(g) ΔH = - 241,8 kJ mol-1
Ç(s) + 2H2 (g) → CH4 (g) ΔH = - 74,8 kJ mol-1
Entalpiverdien til ligning 1, i kJ, er:
a) - 704,6
b) - 725.4
c) - 802.3
d) - 524,8
e) - 110,5
c) - 802.3
2. (UNEMAT-2009) Hess 'lov er av grunnleggende betydning i studiet av termokjemi og kan uttales som “variasjonen av entalpi i en kjemisk reaksjon avhenger bare av den opprinnelige og endelige tilstanden til reaksjon". En av konsekvensene av Hess 'lov er at termokjemiske ligninger kan behandles algebraisk.
Gitt ligningene:
Ç (grafitt) + O2 (g) → CO2 (g) ΔH1 = -393,3 kj
Ç (Diamant) + O2 (g) → CO2 (g) ΔH2 = -395,2 kj
Basert på informasjonen ovenfor, beregne entalpiendringen av grafittkarbon til diamantkarbon og kryss av riktig alternativ.
a) -788,5 kj
b) +1.9 kj
c) +788,5 kj
d) -1,9 kj
e) +98,1 kj
b) +1.9 kj