O pH av en løsning indikerer innholdet (måling) av hydroniumioner (H3O+) til stede i midten. Dette innholdet avgjør om den analyserte løsningen har en sur, basisk eller nøytral karakter.
Observasjon: Det er bemerkelsesverdig at hydroniuminnholdet (H3O+ eller H+) kan bare anskaffes i laboratoriet ved hjelp av pH-indikatorbånd - som imidlertid ikke har stor nøyaktighet i tiltaket - eller ved hjelp av utstyr som kalles et peagometer, som tvert imot har stor nøyaktighet i å måle pH i en løsning.
Skritteller eller potensiometer for å måle pH i en løsning
Å gjennomføre beregninger som involverer pH av en løsning kan vi bruke følgende logaritmiske ligning:
pH = - logg [H3O+]
eller
pH = - logg [H+]
VIKTIG: I beregninger som involverer pH i en løsning, bruker vi alltid logaritmen base 10.
Mind Map: Beregning av PH av løsninger

* For å laste ned tankekartet i PDF, Klikk her!
Fra den logaritmiske ligningen ovenfor kan vi fortsatt bruke følgende forenkling (oppnådd ved å bruke en logaritmisk funksjon) av denne ligningen:
[H3O+] = 10-pH
Observasjon: Det forenklede uttrykket ovenfor kan bare brukes hvis pH-verdien er heltall; ellers må den logaritmiske funksjonen brukes.
Det er viktig å understreke at beregninger som involverer pH i en løsning alltid er relatert til pOH (hydroksylionisk potensial / OH-), siden begge potensene er basert på selvionisering av vann (Kw = 10-14, et fenomen der vann produserer så mye H+ hvor mye oh-) og Ostwalds lov om fortynning (jo mer fortynnet en løsning, jo større mengde H-kationer+ ). Og dermed:
Om vann autoionisering:
Kw = [H+]. [Åh-], så pH + pOH = 14
lov av Ostwald fortynning(Gjennom det kan vi vite hvor mye et bestemt materiale ioniserer eller dissosierer i vann):
KJeg = M.α2
Ki = ioniseringskonstant for et stoff i et vandig medium;
M = molaritet eller molar konsentrasjon av stoffet i det vandige mediet;
α2 = grad av ionisering eller dissosiasjon av materialet i mediet.
Klassifiseringen av en løsning som sur, basisk eller nøytral vil ha følgende kriterier (a 25 OÇ):
-
en løsningen vil være nøytral når konsentrasjonen av H+ er lik konsentrasjonen av OH- eller ha en pH lik 7.
Ikke stopp nå... Det er mer etter annonseringen;)
[H+] = [OH-]
en løsningen vil være sur når konsentrasjonen av H+ er større enn OH-konsentrasjonen- eller pH er mellom 0 og 7.
[H+]> [OH-]
en løsningen vil være grunnleggende når konsentrasjonen av H+ er mindre enn OH-konsentrasjonen- eller pH er mellom 7 og 14.
[H+] -]
Se noen eksempler på beregninger som involverer pH i løsninger:
1º)Å vite at konsentrasjonen av hydronium i en kaffe er lik 1,10-5, hva vil pH være tilstede i denne løsningen?
hvordan du trener ga hydroniumkonsentrasjonen for kaffe, kan vi bruk den forenklede pH-formelen:
[H3O+] = 10-pH
1.10-5 = 10-pH
10-5 = 10-pH
-5 = -pH
pH = 5
Siden pH er mindre enn 7, er løsningen sur.
2º) (UFU) Hva er pH i en 0,045 mol / L eddiksyreoppløsning, forutsatt at den er KJeg = 1,.10-5? Data: logg 2 = 0,3; logg 3 = 0,48.
Treningsdata:
M = 0,045 mol / l
KJeg = 1,8.10-5
logg 2 = 0,3
logg 3 = 0,48
Hvordan øvelsen ga molaritet (M) og ioniseringskonstanten (KJeg),la oss først bestemme graden av ionisering av den nevnte syren, fordi konsentrasjonen av hydronium (H3O+ eller H+) er alltid resultatet av multiplikasjonen mellom molariteten og graden av ionisering. Snart:
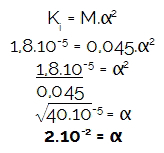
La oss deretter beregne mengden hydronium som multipliserer molariteten av syren etter graden av ionisering som ble funnet:
[H3O+] = M.α
[H3O+] = 0,045.2.10-2
[H3O+] = 0,09.10-4
[H3O+] = 9.10-4 mol / L.
Til slutt setter vi hydroniumkonsentrasjonsverdi i den logaritmiske pH-ligningen:
pH = - logg [H3O+]
pH = - log 9.10-4
pH = 4 - logg 9
pH = 4-log 32
pH = 4 - 2. (logg 3)
pH = 4- (2.0.48)
pH = 4-0,96
pH = 3,04
Siden pH er mindre enn 7, er løsningen sur.
3º)(Cefet-PR) A 45 OC, Kw av en nøytral løsning er lik 4.10-4. Så hva er pH-verdien til denne løsningen ved denne temperaturen? Logg 2 data = 0,3.
Hvordan øvelsen forteller deg at løsningen er nøytralsnart [H3O+] er lik [OH-]:

Til slutt setter vi hydroniumkonsentrasjonsverdi i den logaritmiske pH-ligningen:
pH = - logg [H+]
pH = - log 2.10-7
pH = 7 - logg 2
pH = 7-0,3
pH = 6,7
Siden pH er nesten 7, er løsningen nøytral (som angitt i treningsuttalelsen) fordi temperaturen er 45 OÇ.
Av meg. Diogo Lopes Dias
Vil du referere til denne teksten i et skole- eller akademisk arbeid? Se:
DAGER, Diogo Lopes. "Beregninger som involverer pH i løsninger"; Brasilskolen. Tilgjengelig i: https://brasilescola.uol.com.br/quimica/calculos-envolvendo-ph-solucoes.htm. Tilgang 28. juni 2021.
Ostwalds lov, ioniseringskonstant, molar konsentrasjon, grad av ionisering, svak elektrolytt, antall mol ionisert, Friedrich Wilhelm Ostwald, monosyrer, monobaser.