Den tredje loven om termodynamikk omhandler materiens oppførsel med en entropi som nærmer seg null.
I følge denne loven, når et system er i termodynamisk likevekt, nærmer dets entropi seg null.
Den andre loven om termodynamikk er knyttet til entropi. Deretter vises den tredje loven som en forsøke å etablere et absolutt referansepunkt som bestemmer entropien.
Walther Nernst (1864-1941) var fysikeren som behandlet prinsippene som dannet grunnlaget for den tredje loven om termodynamikk.
I følge Nernst vil entropi ha en minimumsverdi hvis temperaturen til et rent stoff var lik eller nærmer seg absolutt null.
For det foreslo Nernst formelen nedenfor, som viser at variasjonen av entropi (AS) og temperatur (T) har en tendens til minimumsverdier, det vil si 0:
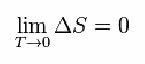
Men hva er Entropy?
Entropi det er slik molekyler organiserer seg i systemet. Denne organisasjonen oversettes til uorden, ikke i form av forvirring, men i form av bevegelse og agitasjon av molekyler.
Jo flere molekyler kan bevege seg, jo mer uorganiserte er de, jo mer entropi har de.
Opprinnelig foreslo Nernst at entropien han foreslo ville være mulig bare på perfekte krystaller.
Til slutt konkluderte han med at temperaturen lik absolutt null ikke eksisterte, noe som gjør den tredje loven til en kontroversiell lov.
Så for mange fysikere er dette ikke en lov, men en regel.
Etter så mange år (siden 1912) prøver forskere å oppnå denne temperaturen eller temperaturene som kommer nærmere og nærmere absolutt null. Dermed oppdaget de at det bare er mulig i gasser, og kasser ethvert stoff i fast eller flytende tilstand.
Les også:
- Zero Law of Thermodynamics
- Første lov om termodynamikk
- Andre lov om termodynamikk
- Øvelser på termodynamikk