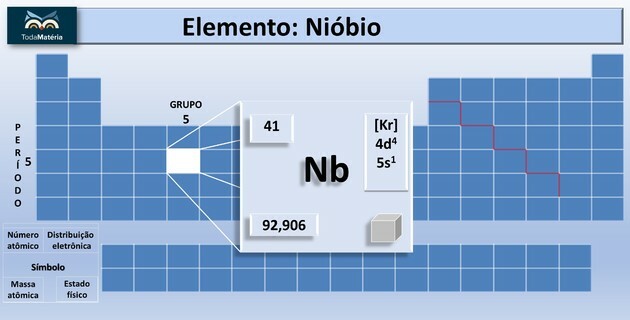
Niob (Nb) er det kjemiske elementet i atomnummer 41 som tilhører gruppe 5 i det periodiske systemet.
Det er et naturlig tilgjengelig overgangsmetall i fast tilstand, som ble oppdaget i 1801 av den britiske kjemikeren Charles Hatchett.
Mineraler som inneholder niob er sjeldne i verden, men rikelig i Brasil, landet med de største reservene av dette metallet.
På grunn av dets egenskaper, høy ledningsevne og korrosjonsbestandighet, har dette elementet mange bruksområder, alt fra stålproduksjon til rakettproduksjon.
Deretter vil vi introdusere dette kjemiske elementet og egenskapene som gjør det så viktig.
Hva er niob?
Niob er et ildfast metall, det vil si at det er veldig motstandsdyktig mot varme og slitasje.
Metallene i denne klassen er: niob, wolfram, molybden, tantal og rhenium, med niob som den letteste av alle.
Niob forekommer i naturen i mineraler, vanligvis knyttet til andre grunnstoffer, hovedsakelig tantal, da de to har veldig like fysisk-kjemiske egenskaper.
Dette kjemiske elementet er klassifisert som et overgangsmetall i det periodiske systemet. Det er lyst, med lav hardhet, med lav motstand mot gjennomføring av elektrisk strøm og motstandsdyktig mot korrosjon.
Fysiske egenskaper av Niobium
| fysisk tilstand | fast ved romtemperatur |
|---|---|
| farge og utseende | metallgrå |
| Tetthet | 8,570 g / cm3 |
| Fusjonspunkt | 2468 ° C |
| Kokepunkt | 4742 ° C |
| Krystallinsk struktur | Body Centered Cubic - CCC |
termisk ledningsevne |
54,2 W m-1 K-1 |
Kjemiske egenskaper av Niobium
| Klassifisering | overgangsmetall |
|---|---|
| atomnummer | 41 |
| Blokkere | d |
| Gruppe | 5 |
| Tidsforløpet | 5 |
| atomvekt | 92,90638 u |
| atomstråle | 1,429 Å |
| vanlige ioner | Nb5+ og Nb3+ |
| elektronegativitet | 1.6 Pauling |
Den største fordelen med å bruke dette metallet er at bare en mengde, i gram, av dette elementet kan modifisere massevis av jern, noe som gjør metallet lettere, motstandsdyktig mot korrosjon og mer effektiv.
Hvor er Niobium funnet?
Sammenlignet med andre stoffer som finnes i naturen, har niob en lav konsentrasjon, i andelen 24 deler per million.
Dette metallet finnes i følgende land: Brasil, Canada, Australia, Egypt, Den demokratiske republikken Kongo, Grønland, Russland, Finland, Gabon og Tanzania.
Niob i Brasil
På 1950-tallet ble den største forekomsten av pyroklor, som inneholder dette metallet, oppdaget i Brasil av den brasilianske geologen Djalma Guimarães.
Den store mengden malm som inneholder niob ligger i Brasil, verdens største produsent, som har mer enn 90% av metallets reserver.
De utforskede reservene ligger i delstatene Minas Gerais, Amazonas, Goiás og Rondônia.
niobmalmer
Niob er funnet i naturen alltid knyttet til andre kjemiske elementer. Mer enn 90 mineralarter som inneholder niob og tantal i naturen er allerede kjent.
I tabellen nedenfor kan vi se noen av malmene som inneholder niob, hovedegenskapene og niobinnholdet som er tilgjengelig i hvert materiale.
| columbite tantalitt | |
|---|---|
 | |
| Sammensetning: | (Fe, Mn) (Nb, Ta)2O6 |
| Niobinnhold (maksimum): | 76% av Nb2O5 |
| Funksjoner: |
|
| Pyrokloritt | |
|---|---|
 | |
| Sammensetning: | (På2,Her)2(Nb, Ti) (O, F)7 |
| Niobinnhold (maksimum): | 71% av Nb2O5 |
| Funksjoner: |
|
| Loparitt | |
|---|---|
 | |
| Sammensetning: | (C, Na, C)2(Ti, Nb)2O6 |
| Niobinnhold (maksimum): | 20% av Nb2O5 |
| Funksjoner: |
|
niob leting
Niobmalmer gjennomgår transformasjoner til produktene som skal markedsføres, dannes.
Prosessstrinnene kan oppsummeres som:
- Gruvedrift
- Niobkonsentrasjon
- Niob raffinering
- Niobium-produkter
Gruvedrift foregår der det er malmreserver som utvinnes ved hjelp av eksplosiver og transporteres med belter dit konsentrasjonsfasen finner sted.
Konsentrasjon skjer med nedbryting av malmen, sliping gjør malmkrystallene til å bli mye finere og bruke magnetisk separasjon jernfraksjonene fjernes fra malmen.
Ved raffinering av niob er det fjerning av svovel, vann, fosfor og bly.
Et av produktene som inneholder niob er jern-nioblegeringen, som produseres i henhold til følgende ligning:
Denne prosessen kalles aluminotermi der malmkonsentratet blandes i reaktorer med jernskrap eller jernoksid.
Metalloksider reagerer med aluminium under høye temperaturer, og genererer produktet av interesse.
De mest kommersialiserte niob-produktene er:
- Niobkonsentrater: en base som inneholder 58% Nb2O5.
- Jern-niob-legering: inneholder 65% niob.
- Oksid med høy renhet: brukes til produksjon av spesielle materialer.
Hva er niob for?
Egenskapene til niob gjør dette elementet stadig mer ønskelig og med utallige bruksområder.
Siden oppdagelsen i 1905 begynte søknader om niob å bli undersøkt, da den tyske kjemikeren Werner von Bolton produserte elementet i ren form.
50-tallet representerte et flott søk etter niob-applikasjoner, da det til da ikke ble produsert i stor skala.
I løpet av denne perioden utløste den kalde krigen interessen for at dette metallet skulle brukes i luftfartkomponenter.
Nedenfor er en liste over måtene niob brukes på.
Metalllegeringer

Tilsetningen av niob til en legering øker herdbarheten, dvs. evnen til å herde når den utsettes for varme og deretter avkjøles. Dermed kan materialet som inneholder niob underkastes spesifikke varmebehandlinger.
Affiniteten til niob med karbon og nitrogen favoriserer legeringens mekaniske egenskaper, og øker for eksempel mekanisk styrke og motstand mot slitasje.
Disse effektene er gunstige ettersom de kan utvide en legerings industrielle applikasjoner.
Stål er for eksempel en metalllegering dannet av jern og karbon. Tilsetning av niob til denne legeringen kan ha fordeler for:
- Bilindustri: produserer en bil lettere og mer motstandsdyktig mot kollisjon.
- Konstruksjon: forbedrer stålets sveisbarhet og gir smidighet.
- Transportrørledningsindustri: Tillater konstruksjoner med tynnere vegger og større diametre, uten å påvirke sikkerheten.
superlegeringer

Superlegeringen er en metalllegering med høy motstand mot høye temperaturer og mekanisk styrke. Legeringer som inneholder niob gjør dette materialet nyttig ved fremstilling av flyturbiner eller energiproduksjon.
Fordelen med å operere ved høye temperaturer gjør at superlegeringer komponerer høyytelses jetmotorer.
superledende magneter

Superledningsevnen til niob fører til at forbindelsene av niob-germanium, niob-skandium og niob-titan brukes i:
- Skanner av MR-maskiner.
- Partikkelakseleratorer som Large Hadron Collider.
- Påvisning av elektromagnetisk stråling og studier av kosmisk stråling av materialer som inneholder niobnitrit.
Oksider
Andre anvendelser for niob er i form av oksider, hovedsakelig Nb2O5. De viktigste bruksområdene er:
- optiske linser
- Keramiske kondensatorer
- pH-sensorer
- motordeler
- Smykker
Historie og oppdagelse av Niobium
I 1734 ble noen malm som tilhørte en personlig samling av John Winthrop ført fra Amerika til England, og disse varene var en del av samlingen til British Museum i London.
Da han begynte i Royal Society, fokuserte den britiske kjemikeren Charles Hatchett på å undersøke sammensetningen av malmene som var tilgjengelige på museet. Dette er hvordan han i 1801 isolerte et kjemisk element i form av et oksid og kalte det columbium og malmen det ble ekstrahert columbite fra.
I 1802 rapporterte den svenske kjemikeren Anders Gustaf Ekeberg oppdagelsen av et nytt kjemisk element og kalte det tantal, med henvisning til sønnen til Zeus i gresk mytologi.
I 1809 analyserte den engelske kjemikeren og fysikeren William Hyde Wollaston disse to elementene og observerte at de hadde veldig like egenskaper.
På grunn av dette faktum ble columbium og tantal fra 1809 til 1846 ansett som det samme elementet.
Senere bemerket den tyske mineralogen og kjemikeren Heinrich Rose, som undersøkte columbittmalmen, at tantal også var til stede.
Rose fant tilstedeværelsen av et annet element, som ligner på tantal, og kalte det Niobius, med henvisning til Niobe, datter av Tantalus, fra gresk mytologi.
I 1864 klarte svenske Christian Bromstrand å isolere niob fra en prøve av klorid oppvarmet i en hydrogenatmosfære.
I 1950 godkjente Union of Pure and Applied Chemistry (IUPAC) niob som det offisielle navnet, i stedet for columbium, da de var det samme kjemiske elementet.
Niobium Sammendrag
Kjemisk element: Niob | |||
|---|---|---|---|
| Symbol | Nb | Oppdageren | Charles Hatchett |
| atomnummer | 41 | atommasse | 92,906 u |
| Gruppe | 5 | Tidsforløpet | 5 |
| Klassifisering | overgangsmetall | Elektronisk distribusjon | [Kr] 4d35s2 |
| Funksjoner |
|
||
| Hovedmalm |
|
||
| Hovedprodukter |
|
||
| applikasjoner |
|
||
| Hendelse | I verden |
|
|
| I Brasil |
|
Fiendøvelser og opptaksprøver
1. (Enem / 2018) I gresk mytologi var Niobia datter av Tantalus, to tegn kjent for lidelse. Det kjemiske elementet atomnummer (Z) som er lik 41 har kjemiske og fysiske egenskaper så like elementet atomnummer 73 at de ble forvirret.
Derfor, til ære for disse to tegnene i gresk mytologi, fikk disse elementene navnene niob (Z = 41) og tantal (Z = 73). Disse to kjemiske elementene har fått stor økonomisk betydning i metallurgi, i produksjonen av superledere og i andre high-end industriapplikasjoner, nettopp på grunn av de kjemiske og fysiske egenskapene felles for begge.
KEAN, S. Den forsvinnende skjeen: og andre sanne historier om galskap, kjærlighet og død fra kjemiske elementer. Rio de Janeiro: Zahar, 2011 (tilpasset).
Den økonomiske og teknologiske betydningen av disse elementene, på grunn av likheten mellom deres kjemiske og fysiske egenskaper, skyldes
a) ha elektroner i undernivå.
b) være elementer av intern overgang.
c) tilhører samme gruppe på det periodiske systemet.
d) ha sine ytterste elektroner på henholdsvis nivå 4 og 5.
e) være lokalisert i henholdsvis familien av jordalkalier og jordalkalier.
Riktig alternativ: c) tilhører samme gruppe på det periodiske systemet.
Det periodiske systemet er organisert i 18 grupper (familier), hvor hver gruppe samler kjemiske elementer med lignende egenskaper.
Disse likhetene skjer fordi elementene i en gruppe har samme antall elektroner i valensskallet.
Gjør vi den elektroniske distribusjonen og legger til elektronene fra det mest energiske undernivået til det ytterste undernivået, finner vi gruppen de to elementene tilhører.
| Niob | |
|
Fordeling elektronikk |
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p65s2 4d3 |
|
summen av elektroner |
mer energisk + mer ekstern 4d3 + 5s2 = 5 elektroner |
| Gruppe | 5 |
| Tantal | |
|
Fordeling elektronikk |
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p66s2 4f145d3 |
|
summen av elektroner |
mer energisk + mer ekstern 5d3 + 6s2 = 5 elektroner |
| Gruppe | 5 |
Elementene niob og tantal:
- De tilhører samme gruppe på det periodiske systemet.
- De har sine ytterste elektroner på henholdsvis nivå 5 og 6, og ligger så i 5. og 6. periode.
- De har elektroner i undernivå, og derfor er de overgangselementer utenfor.
2. (IFPE / 2018) Brasil er verdens største produsent av niob, og står for mer enn 90% av reserven til dette metallet. Niobium, symbol Nb, brukes i produksjonen av spesialstål og er et av de mest motstandsdyktige metaller mot korrosjon og ekstreme temperaturer. Nb-forbindelsen2O5 det er forløperen til nesten alle legeringer og niobforbindelser. Kryss av for alternativet med den nødvendige massen av Nb2O5 for å oppnå 465 gram niob. Gitt: Nb = 93 g / mol og O = 16 g / mol.
a) 275 g
b) 330 g
c) 930 g
d) 465 g
e) 665 g
Riktig alternativ: e) 665 g
Forløperforbindelsen til niob er Nb-oksid2O5 og niob som brukes i legeringene er i grunnform Nb.
Derfor har vi følgende støkiometriske forhold:
1 mol Nb2O5 genererer 2 mol Nb, ettersom nioboksyd dannes av 2 atomer av dette metallet.
Første trinn: beregne antall mol produsert niob som tilsvarer 465 g.
Hvis vi ved beregningen så at massen av niob tilsvarer 5 mol, så antall mol Nb2O5 brukt er halvparten av denne verdien, fordi:
2. trinn: beregne molmassen av nioboksid.
Tredje trinn: beregne massen av nioboksid som tilsvarer 2,5 mol.
3. (UECE / 2015) Brasil eier 98% av verdens niobreserver, som har mange industrielle applikasjoner, for eksempel innen smykkeproduksjon, hyperallergeniske implantater, elektrokeramikk, superledende magneter, magnetiske resonansmaskiner, metalllegeringer, spesielle mynter og i produksjon av stål. For niob, gå gjennom uttalelsene nedenfor og kryss av det eneste sanne alternativet.
a) Dens differensielle elektron er plassert i det nest siste skallet.
b) Det er et representativt element.
c) Dens elektronegativitet er lavere enn for vanadium.
d) Den tilhører den fjerde perioden i det periodiske systemet.
Riktig alternativ: a) Differensialelektronet er lokalisert i det nest siste skallet.
Når du utfører den elektroniske distribusjonen av niob, er det mulig å se at dens differensialelektron er plassert i det nest siste skallet.
Fordi den har differensialelektronet i d-undernivået, er det et ytre overgangselement.
Siden det ytterste nivået er i det femte laget, ligger niob i den femte perioden av tabellen.
Elektronegativitet er egenskapen relatert til elementets evne til å tiltrekke seg elektroner, og det varierer i henhold til atomradius: jo mindre atomradius, jo større tiltrekningskraft for elektroner og derfor jo større elektronegativitet.
Ved å konsultere tabellen med elektronegativitetsverdiene er det mulig å se at niob og vanadium har verdier nær 1,6 Pauling.
4. (UEA / 2014) Den naturlige isotopen til niob er 93Nb. Antall nøytroner i denne isotopen er
a) 41.
b) 52.
c) 93.
d) 134.
e) 144.
Riktig alternativ: b) 52.
Isotoper er atomer av et kjemisk element med forskjellige massetall.
Atommassa tilsvarer summen av protonene og nøytronene til et element.
Antallet protoner representerer atomnummeret til det kjemiske elementet, og for isotoper endres det ikke.
Dermed oppstår massevariasjonen av isotoper på grunn av det forskjellige antall nøytroner.
Hvis atomnummeret til niob er 41, blir antall nøytroner gitt ved beregningen:
5. (IFMG / 2015) Det kjemiske elementet niob, Nb, er oppkalt etter den greske gudinnen Niobe. Brasil er verdens største produsent av metallet og står for 75% av produksjonen. På grunn av legeringenes termiske stabilitet, brukes niob i produksjonen av spesielle høyfast stållegeringer for motorer, fremdriftsutstyr og forskjellige superledende materialer. Når man observerer posisjonen til niob i det periodiske systemet, er det riktig å si at:
a) ditt mest energiske undernivå vil være undernivå d.
b) er et element som tilhører alkalimetallfamilien.
c) danner ioniske forbindelser med andre metaller.
d) dets kationer vil ha en atomeradius større enn det rene elementet.
Riktig alternativ: a) ditt mest energiske undernivå vil være undernivå d.
Ved å se på det periodiske systemet kan vi se at niob karakteriseres som et ytre overgangselement, som tilhører gruppe 5 i det periodiske systemet, da dets mest energiske undernivå er d.
Vi kan også få denne informasjonen ved å distribuere den elektronisk.
Siden det er et metall, lager dette elementet metalliske forbindelser med andre metaller, som i legeringen jern-niob eller også kovalente bindinger, ved å dele elektroner, som i nioboksid Nb2O5.
6. (UFSC / 2003) Niob ble oppdaget i 1801 av den engelske kjemikeren Charles Hatchett. Brasil eier omtrent 93% av verdensproduksjonen av niobkonsentrat. De største innskuddene ligger i delstatene Minas Gerais, Goiás og Amazonas. Metallet brukes hovedsakelig til fremstilling av jern-nioblegeringer og andre mer komplekse legeringer, som har blitt brukt i konstruksjonen av jetfremdriftsturbiner, raketter og romfartøy. Dens oksider brukes til fremstilling av lette linser til briller, fotografiske kameraer og annet optisk utstyr. Gitt (Z = 41). Når det gjelder niob, merker du KORREKT forslag (er).
(01) Når niobium mister 3 elektroner, antas konfigurasjonen av krypton.
(02) Niob kan danne M-type metalloksider2O5 i2O3.
(04) Det kjemiske symbolet for niob er Ni.
(08) Niob er et overgangsmetall.
(16) En jern-niob-legering er et eksempel på en fast løsning.
Riktige alternativer: 02 + 08 + 16 = 26.
(01) FEIL.
| Elementer | Elektronisk distribusjon |
| 36Kr | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 |
|
41Nb 41Nb3+ |
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d3 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 4p6 4d2 |
(02) KORREKT
Med tanke på oksidasjonstallene 3+ og 5+ for niob, kan det danne forbindelsene:
| Oksidasjonsnummer 5+ | Oksidasjonsnummer 3+ |
| Nb2O5 | Nb2O3 |
(04) FEIL
Ni er symbolet for elementet nikkel. Symbolet for niob er Nb.
(08) KORREKT
Niob er et eksternt overgangsmetall som tilhører gruppe 5 i det periodiske systemet.
(16) RIKTIG
En fast løsning tilsvarer at en blanding av to eller flere komponenter i samme fase, som er fast, er vanlig blant metaller.
7. (UERJ / 2013) Niob er et metall som finnes i naturlige avsetninger, hovedsakelig i form av oksider.
I en avsetning som inneholder niob med et oksidasjonsnummer +5, tilsvarer formelen for det dominerende oksydet av dette metallet:
a) NbO5
b) Nb5O
c) Nb5O2
d) Nb2O5
Riktig alternativ: d) Nb2O5
Oksygen gir to bindinger og har et fast oksidasjonsnummer, som er 2-.
Derfor, for å danne nioboksid, må oksygen binde til 2 atomer av dette metallet.
Niob har forskjellige oksidasjonstilstander. Med oksidasjon nummer 3+ binder den seg til 3 oksygener, og med Nox 5+ danner den forbindelsen: Nb2O5 hvor 2 niobatomer binder seg med 5 oksygenatomer.
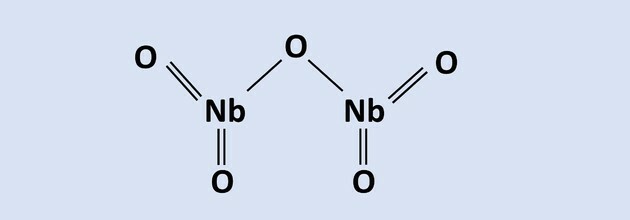
Les teksten for å svare på spørsmål 8 til 10.
Niob er et metall av stor teknologisk betydning, og dets viktigste verdensreserver ligger i
Brasil, i form av pyroklorim, bestående av Nb2O5. I en av prosessene for ekstraksjonsmetallurgi brukes aluminotermi i nærvær av Fe-oksid2O3, som resulterer i en legering av niob og jern og aluminiumoksid som biprodukt. Reaksjonen til denne prosessen er representert i ligningen:
I naturen vises niob i form av den stabile isotopen niob-93, men det er kjent flere ustabile syntetiske isotoper som forfaller ved stråling. En av dem er niob-95 som forfaller til grunnstoffet molybden-95.
(Systems.dnpm.gov.br; Teknisk. Metall. Mater. Miner., São Paulo, v. 6, nei 4, s. 185-191, april-juni. 2010 og G. Audi et al./Nuclear Physics A 729 (2003) 3–128. Tilpasset)
8. (FGV / 2019) I aluminotermi-reaksjonen for å oppnå legering av niob og jern, med tanke på støkiometrien presentert i den balanserte ligningen, er det totale antallet elektroner involvert i prosessen
a) 6.
b) 12.
c) 18.
d) 24.
e) 36.
Riktig alternativ: e) 36.
Redoksreaksjonen skjer med tap og gevinst av elektroner.
Når et element reduserer, får det elektroner, og når et element oksideres, mister det elektroner.
Når et element reduserer, er det et oksidasjonsmiddel, mens når et element oksiderer, er det et reduksjonsmiddel.
På denne måten er antall elektroner som gikk tapt av et element og ble gitt til et annet, like.
| Element | NOX | Reaksjon | elektroner | |
| Niob |
+5 3Nb2O5 |
0 6Nb |
Reduksjon | 3.2.5 = 30 og- gevinster |
| Jern |
+3 Tro2O3 |
0 2Fe |
Reduksjon | 2.3 = 6 og- gevinster |
| Aluminium |
0 12Al |
+3 6Al2O3 |
Oksidasjon | 6.2.3 = 36 og- tapt |
Aluminiumsladningen på aluminiumoksydproduktet er 3+, det vil si at hvert aluminium har mistet 3 elektroner.
Men i produktene har vi 12 aluminiumatomer, noe som gjør det totale antallet elektroner involvert i prosessen:
12. 3 = 36 elektroner.
9. (FGV / 2019) I en aluminotermi-operasjon for produksjon av niob og jernlegering med støkiometriske mengder Nb2O5 og Fe2O3 og bruk av overflødig metallisk aluminium ble 6,12 tonn Al dannet.2O3. Summen av mengdene, i mol, av niob og jern som anslås å være oppnådd i denne operasjonen er
a) 6 × 104
b) 6 × 106
c) 8 × 103
d) 8 × 104
e) 8 × 106
Riktig alternativ: d) 8 × 104.
1. trinn: beregne molmassen til Al2O3
2. trinn: beregne antall mol Al2O3
Tredje trinn: Utfør de støkiometriske forholdene.
I den kjemiske ligningen ser vi at det er forholdet: 6 mol niob, 6 mol aluminium og 2 mol jern.
Ved forholdet mellom antall dannede mol, har vi:
Og summen av mengdene niob og jern, i mol, er:
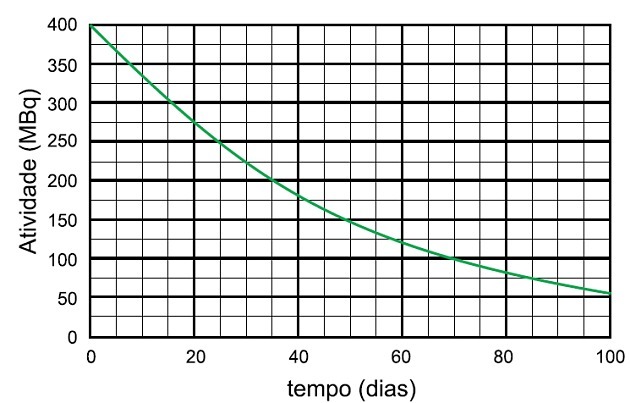
I niobium-95-forfallsprosessen for radioisotop er tiden det tar for aktiviteten til denne prøven å forfalle til 25 MBq og navnet på arten som sendes ut
a) 140 dager og nøytroner.
b) 140 dager og protoner.
c) 120 dager og protoner.
d) 120 dager og partikler ß–.
e) 140 dager og partikler ß–.
Riktig alternativ: e) 140 dager og partikler ß–.
Halveringstiden er tiden det tar for en radioaktiv prøve å halvere aktiviteten.
I grafen ser vi at den radioaktive aktiviteten starter ved 400 MBq, så halveringstiden er tiden det tok for aktiviteten å forfalle til 200 MBq, som er halvparten av den opprinnelige.
Vi analyserer i grafen at denne gangen var 35 dager.
For at aktiviteten skulle falle halvparten igjen, gikk ytterligere 35 dager, og aktiviteten gikk fra 200 MBq til 100 MBq når ytterligere 35 dager gikk, det vil si fra 400 til 100 MBq, det gikk 70 dager.
For at prøven skulle råtne opp til 25 MBq, var det krevd 4 halveringstider.
Som tilsvarer:
4 x 35 dager = 140 dager
Ved radioaktivt forfall kan utslippene være alfa, beta eller gamma.
Gamma-stråling er en elektromagnetisk bølge.
Alpha-utslipp har en positiv ladning og reduserer 4 enheter i masse og 2 enheter i atomnummeret til det forråtnede elementet, og gjør det til et annet element.
Beta-utslipp er et høyhastighetselektron som øker atomnummeret til det forfallne elementet med en enhet, og gjør det til et annet element.
Niob-95 og molybden-95 har samme masse, så det oppstod en beta-utslipp fordi:


