Noen forbindelser har i sin struktur dobbeltbindinger alternerende med enkeltbindinger. Den mest kjente av dem alle er benzen, hvis struktur ble foreslått i 1865 av den tyske kjemikeren Friedrich August Kekulé (1829-1896). Dens struktur ville være syklisk og dannet av tre dobbeltbindinger ispekt med tre enkeltbindinger, som vist i figurene nedenfor:
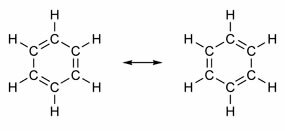
Begge måtene å representere benzen er akseptable, da det er mulig å endre elektronene i π-bindingene uten å endre atomenes posisjon. Imidlertid representerer verken nøyaktig hva han er eller forklarer oppførselen. Den skal oppføre seg som et alken og fremkalle tilleggsreaksjoner, men i praksis skjer ikke dette. Benzen er ganske stabil og fungerer som om den ikke har dobbeltbindinger; det gir substitusjonsreaksjoner som i alkaner.
I 1930 foreslo den amerikanske forskeren Linus Pauling resonansteorien som forklarte denne tilsynelatende motsetningen. Denne teorien sa:
“Hver gang, i en strukturformel, kan vi endre posisjonen til elektronene uten å endre posisjonen til atomene , den virkelige strukturen Nei vil ikke være noen av de oppnådde strukturer, men heller en resonans hybrid av disse strukturene. ”
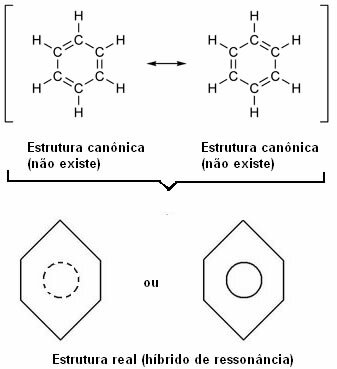
Denne effekten fremgår av størrelsen på karbonbindinger og avstanden mellom dem. Denne avstanden er mellomliggende av den for enkeltbindingen (1,54 Å) og den for dobbeltbindingen (1,34 Å); blir derfor 1,39 Å på grunn av resonanseffekten.
Denne effekten kan også sees i strukturen til ozonmolekylet (O3), som vist under:
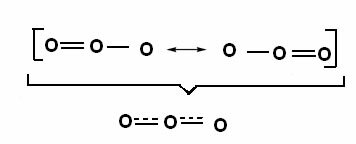
Kanoniske strukturer og ozonresonanshybrider.
Av Jennifer Fogaça
Uteksamen i kjemi
Brasil skolelag.
Kilde: Brasilskolen - https://brasilescola.uol.com.br/quimica/ressonancia-compostosquimicos.htm
