DE elektronegativitet det er tendensen til et atom å tiltrekke elektroner mot seg selv når det er knyttet til et annet kjemisk element. gjennom en kovalent binding, det vil si elektroner deles, med tanke på dette molekylet som værende isolert.
La oss vurdere to eksempler for bedre å forstå konseptet som presenteres:
1. eksempel: Hydrogengassmolekyl: H2 → H - H
Når to hydrogenatomer kommer sammen, oppstår tiltrekningskrefter mellom kjernen til hver på samme tid. ett av disse atomene av elektronet til det andre atomet og frastøtningskrefter mellom elektronene og kjernene til de to atomer. Når disse kreftene når likevekt, er de to elektronene i et område av elektrokulene som er et sted mellom de to. atomer i molekylet, der begge samhandler med de to elektronene og blir stabile, det vil si at de to atomene deler et par elektroner.
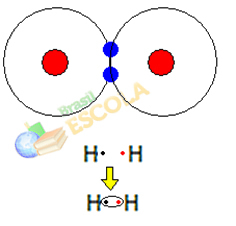
Dette er en kovalent binding, som danner et molekyl. Men siden de to atomene i dette molekylet er nøyaktig de samme, er måten den tiltrekker seg elektroner til hverandre også den samme. Så vi sier det
det er ingen forskjell i elektronegativitet eller at hun det er apolar.2. eksempel: Hydrogenkloridmolekyl: HC2
I dette tilfellet blir delingen av et elektronpar utført mellom forskjellige elementer, fordi i denne forbindelse kloratomet tiltrekker seg elektroner med større intensitet enn hydrogen. Derfor sier vi at klor er mer elektronegativ enn hydrogen.
Som vist i figuren nedenfor, på grunn av forskjellen i elektronegativitet, a elektrisk dipol (μ), som er to elektriske monopoler, med elektroner som er mer tiltrukket av klor. Så bindingen H ─ Cℓ vil ha en delvis negativ ladning på klor (δ-) og en delvis positiv ladning på hydrogen (δ+). Så dette er et molekyl med elektronegativitetsforskjell og er polar:
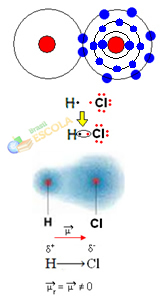
Dette viser oss at elektronegativitet er en relativ snarere enn en absolutt størrelse, da den bestemmes ved å ta i betraktning sammenligninger av krefter som utøves av atomer i en kovalent binding.
Det er flere måter å beregne elektronegativitet på, men den vanligste er elektronegativitetsskalaen foreslått av Pauling. La oss si at vi har et generisk molekyl A ─ B. Pauling foreslo at bindingsenergien til dette molekylet, symbolisert av D, ville bli gitt av summen av det aritmetiske gjennomsnittet av bindingsenergiene (D) av gassmolekylene til disse to atomene, det vil si A-A og B-B, med kvadratet av forskjellen i elektronegativiteter for hvert atom i det molekylet (xDE og xB):
Ikke stopp nå... Det er mer etter annonseringen;)
D(A-B) = [D(A-A) + D(B-B)] + k (xDE - xB)2
Konstanten k i formelen ovenfor er lik 96,5 kJ. mol-1. Pauling tilordnet en vilkårlig verdi for elektronegativiteten til hydrogen, som var 2,1, og på denne måten var det mulig å oppdage elektronegativitetsverdien til de andre elementene i forhold til han.
Basert på denne metoden ble Pauling-elektronegativitetsverdiene gitt for elementene i det periodiske systemet, med unntak av edelgassene.

Merk at disse verdiene er en periodisk egenskap, da de varierer periodisk som en funksjon av atomnummeret til elementene. Se for eksempel at de mest elektronegative elementene er de i øverste høyre hjørne av tabellen, det vil si fluor (4.0) og oksygen (3.5), og minst elektronegativ er de i nedre venstre hjørne, som er francium (0,8) og cesium (0,8).
Basert på dette ble det til og med opprettet en rekke elektronegativitet av de mest elektronegative elementene som pleier å bli bearbeidet mest:
F> O> N> Cℓ> Br> I> S> C> P> H
Se elektronegativitetsverdiene:
4,0 > 3,5 > 3,0 > 3,0 > 2,8 > 2,5 > 2,5 > 2,5 < 2,1
Det er et slags "triks" for å dekorere denne raden av elektronegativitet, som er gitt av setningen nedenfor, der initialen til hvert ord tilsvarer symbolet på de aktuelle elementene:
“Fhei Ohar ikke NO Clube, brjeg har Jegsau Çdøende Pfor Hsykehus"
Så vi kan si det elektronegativitet er en periodisk egenskap som øker fra venstre til høyre og nederst til toppen på det periodiske systemet.

Dette er på grunn av størrelsen på atomradiusen. Jo større radius til et atom er, jo lenger borte er de delte elektronene fra kjernen, og jo svakere er tiltrekningen mellom dem. Det motsatte er også sant, jo mindre atomradius, jo nærmere elektronene vil være kjernen og jo større tiltrekning mellom dem. Dermed kan vi konkludere med følgende:
Elektronegativitet øker med avtagende atomradius.
Av Jennifer Fogaça
Uteksamen i kjemi