DE Kjemisk kinetikk er et felt som studerer faktorene som påvirker hastigheten på utviklingen av kjemiske reaksjoner, det vil si hastigheten de skjer på. Det er mer og mer forskning rundt dette området, ettersom vi ofte vil fremskynde noen reaksjoner eller bremse andre. Dette er spesielt viktig for næringer, og denne forskningen har viktige teknologiske konsekvenser.
Men siden hastigheten på en reaksjon kan variere i hvert tidsintervall og fra et stoff til et annet, er det vanlig å beregne gjennomsnittlig reaksjonshastighet.
Tenk på følgende generiske reaksjon, der koeffisientene er små bokstaver og reaktantene og produktene er representert med store bokstaver:
a A + b B → c C + d D
Gjennomsnittlig hastighet for denne reaksjonen vil bli gitt dividere den gjennomsnittlige reaksjonshastigheten til et av de reagerende stoffene eller den gjennomsnittlige dannelseshastigheten for et av produktene med sin respektive koeffisient i den kjemiske ligningen. Dette er gitt av:
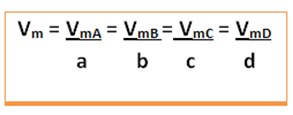
Tenk for eksempel på nedbrytningsreaksjonen for hydrogenperoksid:
2 timer2O2 (aq) → 2 H2O(1) + 1 O2 (g)
La oss si at det på 1 minutt ble dannet 0,3 mol / l H2O og 0,15 mol / L O2mens 0,3 mol / L H dekomponeres2O2, det vil si at de gjennomsnittlige nedbrytningshastighetene og dannelsen av disse stoffene i reaksjonen er:
VmH2O2 = 0,3 mol / l. min
VmH2O = 0,3 mol / l. min
VmO2 = 0,15 mol / l. min
Gjennomsnittshastigheten til den globale reaksjonen vil bli funnet ved å ta en av disse verdiene og dele den med den respektive koeffisienten i ligningen:
Vm = VmH2O2 = 0,3 mol / l. min = 0,15 mol / l. min
2 2
Vm = VmH2O = 0,3 mol / l. min = 0,15 mol / l. min
2 2
Vm = VmO2 = 0,15 mol / l. min = 0,15 mol / l. min
1 1
Vær oppmerksom på at de tre verdiene er like, derfor er reaksjonshastigheten den samme som en funksjon av en hvilken som helst reaktant eller et produkt, i samme tidsintervall.
Men hvordan ble verdiene til gjennomsnittshastighetene til hvert av stoffene som var involvert i disse reaksjonene funnet?
Det kan beregnes dele variasjonen i konsentrasjonen av stoffet (reagens eller produkt) med tidsintervallet. Hvis vi skal bestemme gjennomsnittshastigheten til en av reagenser av reaksjonen, må vi sette et negativt tegn før, ellers vurder konsentrasjonsverdien i modul ||, siden, siden konsentrasjonen av reaktanten synker over tid, vil hastighetsverdien være negativ, men det er ingen negativ hastighet.
Ikke stopp nå... Det er mer etter annonseringen;)

Tenk for eksempel på følgende ozongassnedbrytningsreaksjon (O3 (g)) i oksygengass (O2 (g)):
2 O3 (g) → 3 O2 (g)
La oss si at det i en ballong var 10 mol ozongass, men etter 1 minutt var bare 4 mol igjen; dette betyr at 6 mol ozon ble til oksygengass. Så vi har:
2 O3 (g) → 3 O2 (g)
t = 0 min 2 mol / L 0 mol / L
utgifter dannet
6 mol / L 9 mol / L
t = 1 min 4 mol / L 9 mol / L
Merk at siden reaksjonsforholdet er 2: 3, så hvis 6 mol O ble brukt39 mol O ble dannet2. Så etter 1 minutt har vi følgende gjennomsnittshastigheter:
Vm = - ∆ [The3]
t
Vm = - ([O3final - O3 initial])
tEndelig - tførste
Vm = - ([4 - 10])
1– 0
Vm = 6 mol / l. min→ I 1 minutt reagerte 6 mol ozon i hver liter i systemet.
Vm = ∆ [The2]
t
Vm = ([O2final - O2 innledende])
tEndelig - tførste
Vm = ([9 - 0])
1– 0
Vm = 9 mol / l. min→ I løpet av 1 minutt ble det dannet 9 mol oksygen i hver liter i systemet.
Dette viser oss at vi kan beregne gjennomsnittshastigheten som en funksjon av reaktantene eller som en funksjon av produktene.
Nå, hvis vi vil beregne gjennomsnittshastigheten til denne globale reaksjonen, gjør du bare som vi viste i begynnelsen: del hver av disse hastighetene med deres respektive koeffisienter i den kjemiske ligningen:
Vm = VmO3 = 6 mol / l. min = 3 mol / l. min
2 21
Vm = VmO2 = 9 mol / l. min = 3 mol / l. min
3 3
Vm = VmO3 = VmO2
23
Av Jennifer Fogaça
Uteksamen i kjemi
Vil du referere til denne teksten i et skole- eller akademisk arbeid? Se:
FOGAÇA, Jennifer Rocha Vargas. "Hastighet for kjemiske reaksjoner"; Brasilskolen. Tilgjengelig i: https://brasilescola.uol.com.br/quimica/velocidade-das-reacoes-quimicas.htm. Tilgang 27. juni 2021.


