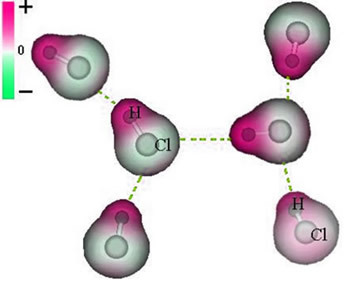
Klorider er de ioniske forbindelsene som inneholder anionet Cℓ-1.
Klor er av 17- eller 7A-familien, atomnummeret er 17 og det har 7 elektroner i valensskallet (atomets ytterste elektronskall). I følge regel av oktetten, for å være stabil, må den ha 8 elektroner i dette siste skallet og må derfor motta ett elektron til. Når dette skjer, det vil si når det mottar et elektron, generelt, fra en ionebinding med et metall, dannes â.nionklorid (Cℓ-1) blir metallet som ga opp elektronet et kation og stoffet som dannes er ionisk.
Klorider er salter avledet fra reaksjonen av en base med saltsyre (HC2(her)). Basen gir kationen og saltsyre gir kloridionet:
Generisk base + saltsyre → Klorid + vann
ÇOH + HCℓ → ÇCℓ + H2O
Klorider er alle klassifisert som uorganiske salterfordi de i et vandig medium frigjør et annet kation enn H+ og frigjør kloridanionet, ikke hydroksylet (OH-).
Nomenklaturen for klorider følger alltid denne regelen: Klorid +de + (navnet på elementet knyttet til klor). På formlene dine er dannet
bytte ioneladninger mot indeksene (tallet som er nederst til høyre på element-symbolet, som indikerer antall atomer for det elementet som er tilstede og lager obligasjoner).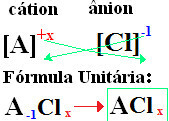
hvis indeksen er "1", du trenger ikke å skrive den i formelen, som vist nedenfor:
På+1 Cℓ-1 → På1Cℓ1 → PåC2: natriumklorid;
K+1 Cℓ-1 → KC2: kaliumklorid;
Her+2 Cℓ-1→CaCℓ2: kalsiumklorid;
Ikke stopp nå... Det er mer etter annonseringen;)
Ba+2 Cℓ-1→ Bher2: bariumklorid;
Aℓ+3 Cℓ-1→ACℓ3: aluminiumklorid.
Som forklart i teksten “Ioniske stoffer i gruppen: klorid, karbonat, nitrat og sulfat”, Som med alle ioniske stoffer, har ikke klorider enhetlige formler isolert i naturen, ettersom ionene deres tiltrekker seg hverandre og danner krystallgitter.
Hovedeksemplet på klorid som vi har i hverdagen er natriumklorid, NaC3, bordsaltet. Se den ioniske bindingen som resulterer i dens dannelse (der natrium donerer et elektron til klor) og under krystallgitteret til dette saltet:
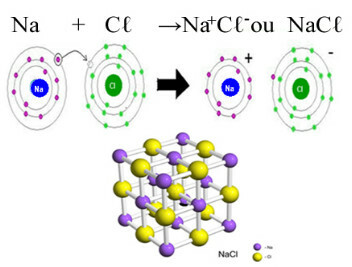
I det krystallinske gitteret av natriumklorid hver anion Cℓ- er omgitt av 6 kationer Na+ og omvendt, så koordinasjonsnummeret til dette krystallgitteret er 6.
Alle klorider er faste stoffer i omgivelsesforhold og ganske vannløselig, er blant de vanligste saltene som finnes i vårt daglige liv, med tanke på at flere av dem er tilstede oppløst i mineralvann, drikkevann, vann fra springen, elver, hav, blant andre. Blant unntakene, som er vannuoppløselige klorider, er sølvklorid (AgCℓ - vist i følgende figur), fra bly, kobber og kvikksølvforbindelser.

Vannuoppløselig sølvklorid *
Cℓ-ionene-1 fra kloridene vi får i oss, hovedsakelig i salt, fisk og kjøtt, er viktige for noen funksjoner i menneskekroppen, da de er det viktigste ekstracellulære anionet, som er tilstede i juice mage, regulere kroppsvæsker, slik som vannfordeling i kroppen, og opprettholde plasma osmotisk trykk og nøytralitet elektrisk.
Dens mangel kan forårsake angst, diaré og sirkulasjonsproblemer. Overskuddet utskilles gjennom urin (i gjennomsnitt utskiller hver person ca. 4 g klorid per dag), svette og avføring.
*Bildekreditt: Forfatter: Danny S. / Bilde hentet fra: Wikimedia Commons
Av Jennifer Fogaça
Uteksamen i kjemi
Vil du referere til denne teksten i et skole- eller akademisk arbeid? Se:
FOGAÇA, Jennifer Rocha Vargas. "Klorider"; Brasilskolen. Tilgjengelig i: https://brasilescola.uol.com.br/quimica/cloretos.htm. Tilgang 28. juni 2021.
Kjemi

Hverdagssalter, kalsiumkarbonat, natriumklorid, natriumfluorid, kaliumnitrat, natriumnitrat natrium, natriumkarbonat, natriumbikarbonat, natriumbikarbonat, natriumsulfitt, saltpeter, soda.