Polymerisering er navnet på den kjemiske prosessen som resulterer i dannelsen av makromolekyler (store molekyler) kalt polymerer, gjennom kombinasjonen av mindre molekyler, monomerene.
reaksjonen av polymerisering det er veldig vanlig i naturen, som vi kan se i karbohydrater (som stivelse) og proteiner (som kasein i melk). Det forekommer også syntetisk, siden det store flertallet av polymerer som brukes av mennesker i deres daglige liv, er laget kunstig.
Den første polymeren produsert av polymerisering syntetisk var bakelitt, i 1909, av den belgiske kjemikeren Leo Hendrik Baekeland.
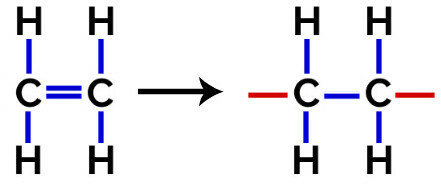
Generelt, for at en monomer skal kombineres med en annen (enten de er like eller forskjellige) i en reaksjon av polymerisering, er det nødvendig at det eksisterer fri valens (kjemisk binding som skal utføres) i begge monomerene.
Disse valensene oppstår som et resultat av bindingen, ved bruk av katalysatorer (for eksempel nikkel), eksterne forhold som lys og varme, eller ved fenomenet resonans i strukturen (skift av elektroner).
I dannelsen av polypropylen (PP-polymer), for eksempel brukt i husholdningsredskaper og leker, er pi lenke (π) i hvert molekyl brytes ned som følger:
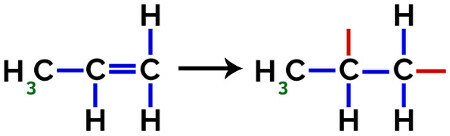
Brudd på pi-binding i propylen
Således kan hver propylenmonomer binde seg med to andre propylenmonomerer og danne polymeren PP eller polypropylen (prefikset poly indikerer flere monomere enheter). Den hyppigste måten å representere en polymer har monomeren mellom parenteser og på utsiden bokstaven n, som indikerer flere monomerer, som vi kan se i tilfelle PP-polymer:
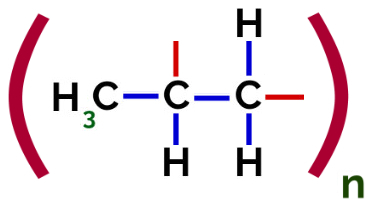
Representasjon av PP-polymer
reaksjonen av polymerisering kan gjøres på forskjellige måter, som vi vil se nedenfor:
a) Reaksjon av tilleggspolymerisering
I dette polymerisering, er det alltid et brudd på en pi-binding i monomeren, som får to frie valenser til å dukke opp i strukturen, som i dannelsen av polyetylen, polymer mye brukt i farmasøytisk emballasje.
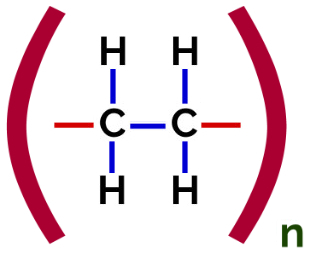
Polyetylen tilleggspolymer strukturell formel
På polymerisering av polyetylen brukes molekyler av etylen (eten) som monomeren, som har en pi-binding mellom de to karbonatomer. Når denne bindingen brytes, vises to frie valenser, en på hvert karbonatom som var involvert i pi-bindingen. Monomerene forener seg nøyaktig i hver av disse valensene, det vil si at den ene valensen er knyttet til den andens valens, og så videre.
Ikke stopp nå... Det er mer etter annonseringen;)
Polyetylenformasjonslikning
b) Tilsetningspolymerisasjonsreaksjon 1.4
I denne polymeriseringen presenterer monomerene to alternerende dobbeltbindinger (en pi og en sigma), som favoriserer fenomenet av resonans (vekslende posisjonen til pi-elektronene til pi-bindingen), som i dannelsen av syntetisk gummi (polybutadien)

Strukturell formel av polybutadien
Den monomere enheten til denne polymeren er butadien, som har to alternerende dobbeltbindinger. Med resonans har strukturen en dobbeltbinding mellom karbon 2 og 3, og to frie valenser på karbon 1 og 4. Det er nettopp i disse frie valensene av karbon 1 og 4 at monomerene kombineres.

Resonans i butadien
c) Reaksjon av kondenspolymerisering eller eliminering
Det er en reaksjon av polymerisering hvor to monomerer (det samme eller forskjellige) obligatorisk samtidig mister atomer eller grupper, noe som resulterer i to frie valenser i hver og en av dem. På denne måten er det alltid eliminering av hydrogen fra en monomer, som deretter forbinder et halogen (F, Cl, Br, I), OH, NH2, eller til CN for den andre monomeren.
Så, i polymerisering ved eliminering er det alltid dannelse av vann, halogenert syre (HCl, HI, HF, HBr), ammoniakk (NH3) eller hydrocyansyre (HCN) i tillegg til polymeren. Se for eksempel representasjonen av dannelsen av polyester, et materiale som brukes som stoff:

Polyesterformasjonslikning
Polyesterdannende monomerer er p-benzensyre og etan-1,2-diol. Vi kan observere det i dette polymerisering eliminering av vannmolekyler skjer, siden de to monomerene har to hydroksyler. I denne prosessen mister syren de to hydroksylene, og dialkoholen mister bare hydrogenet fra hydroksylene:

Polyesterstruktur
Polyestermonomerer er forbundet med oksygen i alkoholen og karbon i karboksylsyren.
Av meg. Diogo Lopes Dias