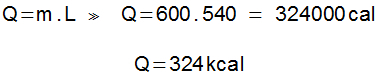entropi er en storhettermodynamikk assosiert med irreversibilitet av tilstandene til et fysisk system. Det er ofte assosiert med graden av "uorden”Eller“tilfeldighet”Av et system. I følge en av uttalelsene fra 2. lov om termodynamikk:
“I et termisk isolert system må måling av entropi alltid øke over tid til den når sin maksimale verdi. "
Med andre ord, entropi er i stand til å måle betydningen av "tidens pil”Av et system. Når vi ser bildene nedenfor, vet vi intuitivt at systemets starttilstand representeres av bildet av venstre, av de største organisasjon:
Når vi ser på forrige bilde, vet vi at den mest sannsynlige endelige konfigurasjonen er den atomer har hastigheter i alle retninger, i tillegg til tilfeldige posisjoner. Det er det entropi handler om: a mangfold av tilstander i et system må alltid øke.
Eksempler
Hvilke av innstillingene nedenfor er mer sannsynlig som skal observeres for et arrangement av murstein over tid?

I den første konfigurasjonen, ble mangfold av tilstandene til blokkene er
litt: de er alle ordnet i retninghorisontal, parallell hverandre. Med tiden eller handlingen til en agent, forventes det at dens konfigurasjon voks opp i Nummer i Stater, favoriserer mandagkonfirmasjon, illustrert på bildet til høyre. Andre eksempler kan gis:-
Når en ispose legges i en beholder med størretemperatur, temperaturen øker til den når termisk balanse. På det tidspunktet kan isen smelte. Ved å ta varmen igjen fra isblokken, som nå er i staten væske, den kan bli solid igjen, men dens konformasjon vil ikke ha den samme organisasjonen som tidligere ble presentert.
Ikke stopp nå... Det er mer etter annonseringen;)
Når du åpner en flaske parfyme, kan varmen hjelpe spredning av din molekyler, spre innholdet i parfymen over hele rommet. Det motsatte kan ikke forventes, siden fjerning av varme ikke ville fremme molekylers retur i kolben.
Matematisk definisjon av Entropy
DE matematisk definisjon av entropi er gitt av forholdet mellom mengden varme (Spørsmål) overført mellom to deler av et termisk isolert system, i joules (J), ved sin absolutte temperatur, i Kelvin (K):

S = Entropi (J / K)
ΔQ = Varmemengde (J)
T = Absolutt temperatur (K)
Definisjonen gitt ovenfor gjelder for isotermiske prosesser, det vil si der det er varmevekslinger så små (eller sakte) at de ikke er i stand til å endre temperaturen i systemet. Definisjonen av entropi er derfor uendelig liten (uendelig liten del).
Vi kan også forstå begrepet entropi som følger: å være et system dannet av to deler av samme gass, i mange forskjelligetemperaturer, er det mulig å trekke ut noe arbeid av at han flyttet noen stempel eller Hånd sveiv, for eksempel. Derimot, over tid, vil delene av denne gassen ha en tendens til å balanseretermisk. Hvis det ikke lenger er forskjell i temperatur, selv med all energien som er tilstede der, vil det ikke være mulig å utvinne noe arbeidnyttig fra han.
Av Rafael Hellerbrock
Uteksamen i fysikk
Vil du referere til denne teksten i et skole- eller akademisk arbeid? Se:
HELERBROCK, Rafael. "Hva er entropi?"; Brasilskolen. Tilgjengelig i: https://brasilescola.uol.com.br/o-que-e/fisica/o-que-e-entropia.htm. Tilgang 28. juni 2021.