I teksten "geometrisk isomer eller cis-trans”Ble vist hvordan geometrisk romlig isomerisme eller cis-trans. Kort fortalt isomeren cis tilsvarer forbindelser hvis like ligander på hvert karbonatom er i samme plan; allerede i isomeren trans, de er på hver sin side.
Dette identifiseres av opprinnelsen til disse begrepene, som kommer fra latin, hvor cis betyr "ved siden av" og trans "på tvers".
Denne nomenklaturen er veldig nyttig når to karbonatomer bare har to forskjellige ligander. Imidlertid kan disse begrepene være tvetydige når det refereres til alkener, hvis karbonatomer med dobbeltbinding har mer enn to forskjellige ligander i settet.
Tenk for eksempel på forbindelsen nedenfor:

Merk at på karbon x den laveste atomantallanden er CH3og på karbon y er H. Men hvis vi skulle si at denne forbindelsen er isomeren cis, kan følgende spørsmål oppstå: hvordan han liker cis hvis bindingsgruppene er like (CH3) er på motsatte sider?
For å unngå denne tvetydigheten er det mer riktig å bruke i disse tilfellene nomenklaturen E-Z, der bokstaven E kommer fra det tyske ordet
entgegen, som betyr "motsetninger" og Z kommer fra det tyske ordet zusammen, som betyr "sammen". Denne nomenklaturen følger følgende regel:
Bruk av denne prioriteringsregelen på 2-klorobu-2-en, vi har det i karbon x liganden med det høyeste atomnummeret er Cl og på karbon y er CH3. Dermed har vi følgende isomerer:
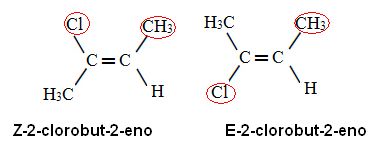
I det første tilfellet er ligandene med høyest atomnummer på samme side av planet (Z), og i det andre er de på motsatte sider (E).
Dette skjer også med sykliske forbindelser. Det er viktig å huske at det ikke er riktig å relatere begrepene cis og Z, og trans og E, ettersom de er forskjellige navngivningssystemer.
Av Jennifer Fogaça
Uteksamen i kjemi
Kilde: Brasilskolen - https://brasilescola.uol.com.br/quimica/isomeria-e-z-no-lugar-cis-trans.htm


