Hess 'lov ble opprettet av sveitsisk kjemiker Germain H. Hess (1802-1850), som regnes som en av grunnleggerne av termokjemi. Hans lov sa:

Det vil si at ΔH bare avhenger av entalpiverdiene til reagensene og produktene, som i uttrykket:
| ΔH = ΔHreagenser + ΔHProdukter |
Tenk for eksempel på reaksjonen der 1 mol vann (H2O) transformeres til vann i gassform. Denne reaksjonen utføres to ganger; imidlertid ble forskjellige veier valgt:
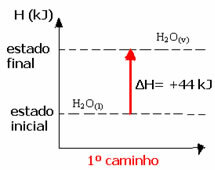
(1.) Den ble utført i et enkelt trinn:
H2O(1) → H2O(v) ΔH = +44 kJ
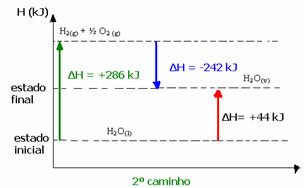
(2.) Den ble utført i to trinn:
1. trinn: H2O(1) → H2 (g) + ½2 (g) ΔH = +286 kJ
2. etappe: H2 (g) + ½2 (g) → H2O(v) ΔH = -242 kJ
H2O(1) → H2O(v) ΔH = +44 kJ
Ikke stopp nå... Det er mer etter annonseringen;)
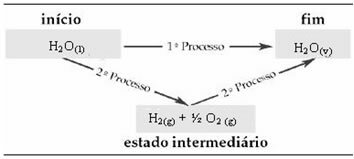
Merk at uansett om ett eller to trinn er utført, er entalpiendringen (ΔH) alltid 44 kJ. Dette er fordi ΔH er den algebraiske summen av ΔH-verdiene til trinnene som utgjør prosessen, det vil si mellomprosessene:
| ΔH = ΔH1 + ΔH2 + ΔH3 + ... |
For eksempel, i det andre tilfellet, var den totale ΔH av reaksjonen summen av ΔH i det første trinnet (ΔH = +286 kJ) med det for det andre (ΔH = -242 kJ). Dermed oppnådde vi den samme reaksjonsverdien med et enkelt trinn:
ΔH = (+286 + (-242)) kJ
ΔH = (+286-242) kJ
ΔH = +44 kJ
Derfor er vi bare interessert i de innledende og endelige verdiene. I dette tilfellet tilsvarer starttilstanden H2O(1) og slutten på H2O(v).
Denne loven har blitt veldig viktig i termokjemi, fordi visse kjemiske reaksjoner ikke kan bestemmes av deres ΔH eksperimentelt. I følge Hess 'lov kan entalpi av denne typen reaksjon imidlertid beregnes ut fra entalpier av andre reaksjoner (mellomreaksjoner).
Av Jennifer Fogaça
Uteksamen i kjemi
Brasil skolelag
Vil du referere til denne teksten i et skole- eller akademisk arbeid? Se:
FOGAÇA, Jennifer Rocha Vargas. "Hess's Law"; Brasilskolen. Tilgjengelig i: https://brasilescola.uol.com.br/quimica/lei-hess.htm. Tilgang 28. juni 2021.


