Metaller er elementer preget av lysstyrke, styrke, termisk og elektrisk ledningsevne. De er anvendelig i praktisk talt alle industrielle prosesser, være til stede i metalllegeringer som brukes til fremstilling av verktøy, smykker og mynter og i kjemiske prosesser som redoks, ansvarlig for driften av stabler og batterier.
I det periodiske systemet er de klassifisert i:
halvmetaller
overgangsmetaller
alkalimetaller
jordalkalimetaller
I stålindustrien er de skilt i:
jernholdige metaller
ikke-jernholdige metaller
tungmetaller
Les også: Hva er de nye elementene i det periodiske systemet?
Metallegenskaper

De er for det meste utmerkede ledere av varme og elektrisk energi.
De har et blankt utseende.
har høye tetthet.
De er elektropositive elementer (de har en tendens til å danne kationer - positive ladninger).
Med unntak av Kvikksølv, de er grunnstoffer med høyt smeltepunkt og faste ved romtemperatur.
De har mekanisk styrke (fasthet).
De er formbare (kan støpes uten å knekke).
Ikke stopp nå... Det er mer etter annonseringen;)
Periodiske tabellmetaller
alkalimetaller
er elementene i første kolonne i det periodiske systemet, familie 1A. De kalles alkalimetaller fordi de, når de blandes med vann, danner hydroksider, det vil si en alkalisk (basisk) løsning.
Du elementer som tilhører denne gruppen er:
Litium (li)
Natrium (På)
Kalium (K)
Rubidium (Rb)
Cesium (Cs)
Francio (Fr)
Den elektroniske konfigurasjonen av alkalimetaller i nøytral tilstand (uladet / ionisert) presenterer bare et elektron i det siste skallet (valenssjikt). O atomstråle og reaktiviteten til disse metallene øker fra topp til bunn (observerer Periodiske tabell). De har et lavt smeltepunkt sammenlignet med andre metaller, er formbare og ikke veldig tette, har et matt aspekt på grunn av høyt oksidasjonspotensial.
Se også:Hva er egenskapene til materie?
jordalkalimetaller
Dette er elementer som vises i andre kolonne i det periodiske systemet, familie 2A. er kalt alkalisk jord av tendensen til å danne løsninger av grunnleggende (alkaliske) karakter, og av jordiske, fordi oksidene dannet av disse stoffene før 1800-tallet ble betegnet på den måten. Dette begrepet ble brukt til å betegne uoppløselige ikke-metaller som ikke gjennomgikk mutasjon ved oppvarming, vanlige egenskaper ved gruppe 2-elementer. Senere, i lys av ny forskning og eksperimenter, ble det oppdaget at "jord" -elementene faktisk var oksider dannet av metaller.
De er formbare metaller, med lav tetthet, har to elektroner i sitt ytterste skall, blir funnet under normale forhold med temperatur og trykk i fast tilstand. Tilhører denne gruppen:
Beryllium (Være)
Magnesium (Mg)
Kalsium (Her)
Strontium (Mr)
Barium (Ba)
Radio (Frosk)
overgangsmetaller
utgjør gruppe B i det periodiske systemet, og er plassert mellom jordalkalimetallene og ametaler. De ble definert av IUPAC som elementer som har et ufullstendig energeticad ’energisk underlag. Begrepet "overgangsmetaller" refererer til overgang fra gruppe 2 til 13 i det periodiske systemet og den økende tilførselen av elektroner i ‘d’ orbitalen.
Overgangsmetallgruppen består av tette elementer, med høye smeltepunkter og kokepunkter, og mindre reaktive enn gruppe 1 og 2 metaller (Familie 1A og 2A). Blant overgangsmetallene er wolfram, som er det grunnleggende smeltepunktet (3422 ° C), og kvikksølv (Hg) som er et metall som er flytende under normale forhold med temperatur og trykk, dets smeltepunkt er (-38,83 ° C).
Overgangsmetaller har forskjellige oksidasjonstilstander (NOX variabel) og danner fargede stoffer.

Interne overgangselementer
Interne overgangselementer de er:
Lanthanides: serier sammensatt av elementer som har fra 57 til 71 protoner og som, med unntak av prometium, er naturlige.
Actinides: gruppe dannet av grunnstoffene fra 89 til 103 i atomnummer og som for det meste er syntetiske. Alle denne gruppen er radioaktivt med kort halveringstid.
Elementene i disse to gruppene har høyt smeltepunkt og er alle faste ved romtemperatur.
Halvmetaller
Du halvmetaller det er i alt syv elementer:
Bor (B)
Silisium (Si)
Germanium (Ge)
Arsen (As)
Antimon (Man)
Tellurium (Te)
Polonium (Po)
Denne klassifiseringen er gitt til elementer som har fysisk-kjemiske egenskaper som er relevante for metaller og også andre som er relevante for ikke-metalliske elementer. Halvmetaller har en glans, er sprø forbindelser, i stand til å danne kationer så vel som anioner (avhengig av tilstanden), og er mellomledere.
Typer metall
Jernholdig: stoffer som inneholder jern i sammensetningen. De er metalllegeringer som inneholder jern som et vanlig element, men kan formuleres med forskjellige konsentrasjoner av karbon, for eksempel, eller smidd med forskjellige teknikker, og dermed ha produkter med forskjellige fysiske egenskaper.
Ikke-jernholdig: legeringer dannet av andre metaller, for eksempel aluminium, kobber, nikkel, sink, titan.
Tungmetaller: bly, nikkel, sink, kvikksølv. De er reaktive, giftige og bioakkumulerende metaller. De brukes blant annet i batterier, lamper, ammunisjon for krigens gjenstander.
Kjemiske bindinger av metaller
Metaller er elementer elektropositive, det vil si at de har en tendens til å miste elektroner i en kjemisk binding. Når et metall samhandler med et ikke-metall, er det utføre en ionisk binding på grunn av forskjellen i elektronegativitet. Den andre bindingsmuligheten for metaller er metallbindinger.
På metallforbindelser mellom metaller, med delvis frigjøring av elektroner og dannelse av en sky eller et hav av elektroner rundt atomene, noe som garanterer metalldelene egenskapene til ledningsevne elektrisk og formbarhet.
Se også: Ledere og isolatorer - hva er forskjellene?
Å skaffe metaller
De fleste metaller finnes naturlig i bergarter og mineraler knyttet til andre grunnstoffer. Det er flere teknikker for raffinering av metaller, for eksempel gjennom elektrolyse og kjemiske reaksjoner på separate forbindelser.
Når det gjelder metaller, er de to mest brukte teknikkene i industriell skala for å oppnå en viss grad av renhet i et metall: forskjell på tetthet og magnetisk mottakelighet (tendens til at metallet må reagere på en magnetfelt).

løste øvelser
Spørsmål 1 - (Enem) Kadmium, som finnes i batterier, kan nå bakken når disse materialene kastes uregelmessig i miljøet eller når de forbrennes. I motsetning til metallformen er Cd2 + -ioner ekstremt farlige for kroppen da de kan erstatte Ca2 + -ioner, forårsaker en degenerativ sykdom i beinene, noe som gjør dem veldig porøse og forårsaker alvorlige smerter i beinene. ledd. De kan også hemme enzymer aktivert av Zn2 + kation, som er ekstremt viktige for nyrenes funksjon. Figuren viser variasjonen i radiusen til noen metaller og deres respektive kationer.
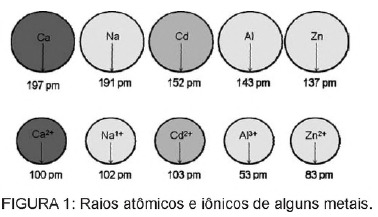
Basert på teksten er giftigheten av kadmium i sin ioniske form en konsekvens av dette elementet
A) har lav ioniseringsenergi, som favoriserer dannelsen av ionet og letter dens binding til andre forbindelser.
B) har en tendens til å handle i biologiske prosesser formidlet av metalliske kationer med ladninger fra +1 til +3.
C) ha en radius og lade relativt nær metallioner som virker på biologiske prosesser, og forårsaker interferens i disse prosessene.
D) har en stor ionisk radius, slik at den forstyrrer biologiske prosesser der mindre ioner normalt deltar.
E) ha en +2 ladning, som gjør det mulig å forstyrre biologiske prosesser der ioner med lavere ladninger normalt deltar.
Vedtak
Alternativ C. Kadmium er et grunnstoff som ligner på metallionene som vi naturlig har i kroppen. I tillegg til å være bioakkumulerende, kan kadmium, som har denne likheten med metallgrupper, binde seg til sulfhydrylgrupper av molekyler protein, og forårsaker dermed endringer i biologiske prosesser, slik som avkalkning, og ødeleggelse av vev og røde blodlegemer blod.
Spørsmål 2 - Merk av for feil alternativ for egenskaper som er relevante for metaller.
A) De fleste metaller er gode elektriske og termiske ledere.
B) Noen metaller er utsatt for oksidasjon og / eller reduksjon.
C) Jern er et motstandsdyktig og formbart metall, det vil si at det er lett å støpe.
D) Jordalkalimetaller har dette navnet “jord” som refererer til oksidene av disse metallene, som er mørke i fargen.
E) Metaller er elementer i forskjellige farger og kjedelige på grunn av oksidasjonsvirkningen.
Vedtak
Alternativ E. Metaller er naturlig blanke og metalliske i fargen, de kan gjennomgå oksidasjon, noe som forårsaker endringer i egenskapene som er relevante for aspekt av delen, men dette er ikke et fenomen som skjer i alle metaller, og i noen tilfeller avhenger oksidasjon av flere faktorer utvendig.
av Laysa Bernardes
Kjemi lærer